ความหมายของการละลาย
การละลาย (Dissolve) คือ การที่สารชนิดหนึ่ง (ตัวถูกละลาย) แตกตัวออกเป็นอนุภาคเล็ก ๆ และแทรกตัวในสารอีกชนิดหนึ่ง (ตัวทำละลาย) โดยทั่วไปเราพิจารณาว่า
- สารที่มีปริมาณมากกว่าเป็น ตัวทำละลาย (Solvent)
- สารที่มีปริมาณน้อยกว่าเป็น ตัวถูกละลาย (Solute)
- สารละลายที่มีน้ำเป็นตัวทำละลายเรียกว่า aqueous solution (aq)
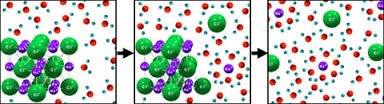
การที่อนุภาคของตัวถูกละลายจะเข้าไปแทรกตัวอยู่ระหว่างอนุภาคของตัวทำละลายได้หรือไม่ จะขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลของตัวทำละลายกับตัวทำละลาย แรงดึงดูดโมเลกุลระหว่างตัวทำละลายกับตัวถูกละลาย และแรงดึงดูดระหว่างโมเลกุลตัวถูกละลายกับตัวถูกละลาย
ปกติแล้ว การที่ตัวถูกละลายจะละลายในตัวทำละลายหนึ่ง ๆ ได้นั้น สารทั้งสองชนิดจะต้องมีสมบัติเหมือนกัน Chemweb.ucc.ie. สืบค้นเมื่อ 2011-06-12.
ตามกฎ like dissolves like ก็คือ ตัวถูกละลายที่มีขั้วจะละลายในตัวทำละลายที่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลมีขั้วเป็นแรงไดโพล-ไดโพล (dipole - dipole) แต่จะไม่ละลายในตัวทำละลายที่ไม่มีขั้ว เช่น เอทานอล (CH3CH2OH) ละลายในน้ำ (H2O) แต่ไม่ละลายในเฮกเซน (C6H14)
ในทางตรงข้าม ตัวถูกละลายที่ไม่มีขั้วจะละลายในตัวทำละลายที่ไม่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลไม่มีขั้ว เป็นแรงแวนเดอร์วาลล์ (Van der Waals force) เหมือนกัน แต่จะไม่ละลายในตัวทำละลายที่มีขั้ว เช่น คาร์บอนเตตระคลอไรด์ (CCl4) ละลายในเบนซีน (C6H6) ไม่ละลายในน้ำ แต่ถ้าในกรณีที่สารหนึ่งมีขั้วน้อยกว่าอีกสารตัวหนึ่ง ความสามารถในการละลายก็ลดลง หรืออาจจะกล่าวอีกนัยคือละลายได้เพียงบางส่วนเท่านั้น
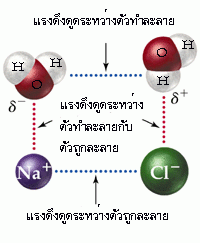
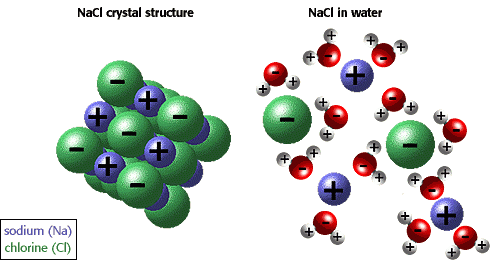
จากที่กล่าวมาจะเป็นการละลายของของเหลวในของเหลวด้วยกัน ในกรณีที่เป็นการละลายของของแข็งในของเหลวก็สามารถอธิบายโดยใช้แรงดึงดูดระหว่างโมเลกุลเช่นเดียวกัน ถ้าตัวถูกละลายเป็นสารประกอบไอออนิก ซึ่งมีแรงดึงดูดระหว่างไอออนสูงมาก ก็จะละลายในตัวทำละลายที่มีขั้วแรงได้ดีกว่าตัวทำละลายที่มีขั้วน้อยกว่า เพราะฉะนั้น สารประกอบไอออนิกจึงละลายได้ดีในตัวทำละลายที่มีขั้วแรงมากๆ เช่น เกลือ (โซเดียมคลอไรด์ : NaCl) ละลายได้ดีในน้ำ มากกว่าในตัวทำละลายที่เป็นสารประกอบพวกไฮโดรคาร์บอน (hydrocarbon compounds)
การละลายจะเป็นประเภทใดขึ้นอยู่กับชนิดของสารและตัวทำละลายที่เกี่ยวข้อง ในขณะที่สารเกิดการละลาย ตัวละลายที่เป็นของแข็งจะแยกตัวเป็นอนุภาคเล็กๆ และยึดเหนี่ยวกับโมเลกุลของตัวละลาย กระบวนการนี้เกี่ยวข้องกับพลังงาน ถ้าพลังงานที่ใช้แยกอนุภาคของของแข็งมีปริมาณน้อยกว่า พลังงานที่เกิดจากการยึดเหนี่ยวระหว่างอนุภาคของตัวละลายกับตัวทำละลาย การละลายของสารนี้จะปล่อยพลังงานออกมา สารละลายจะมีอุณหภูมิสูงขึ้น การละลายประเภทนี้เรียกว่า การละลายประเภทคายความร้อน (n.d.). Merriam-Webster's Medical Dictionary. Retrieved August 19, 2007.
ในทางกลับกัน ถ้าพลังงานที่ใช้ในการแยกอนุภาคของตัวละลายที่เป็นของแข็งมีปริมาณมากกว่า พลังงานที่เกิดจากการยึดเหนี่ยวระหว่างอนุภาคของตัวละลายกับตัวทำละลาย การละลายของสารนี้จะดูดพลังงาน สารละลายจะมีอุณหภูมิต่ำลง การละลายประเภทนี้เรียกว่า การละลายประเภทดูดความร้อน การละลายของของเหลวหรือแก๊สในตัวทำละลายชนิดต่างๆ เกิดขึ้นได้ในทำนองเดียวกัน การละลายของสารแต่ละชนิดจะเป็นการละลายของสารประเภทดูดหรือคายความร้อนเป็นสมบัติเฉพาะตัวของสาร

กระบวนการเกิดสารละลาย
สารละลาย คือ สารเนื้อเดียวที่เกิดจากสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปผสมกัน สารละลายจึงไม่เป็นสารบริสุทธิ์แต่เกิดจากการรวมตัวของสารบริสุทธิ์ โดยที่รวมกันแล้วยังต้องเป็นสารเนื้อเดียว (Homogeneous) เนื่องจากอนุภาคของตัวถูกละลายแทรกตัวในอนุภาคของตัวทำละลายอย่างสม่ำเสมอโดยองค์ประกอบที่มีปริมาณมากที่สุด เรียกว่าตัวทำละลาย (Solvent)ส่วนองค์ประกอบอื่น ๆ ที่มีปริมาณน้อยกว่า เรียกว่า ตัวถูกละลาย (Solute)
การที่อนุภาคของตัวถูกละลายเข้าไปแทนที่อนุภาคของตัวทำละลายเกิดขึ้นได้เมื่อ
- ทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลของตัวทำละลาย
- ทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลของตัวถูกละลาย
- สร้างแรงยึดเหนี่ยวระหว่างโมเลกุลของตัวทำละลายและตัวถูกละลาย
สารแต่ละชนิดมีกระบวนการละลายแตกต่างกัน ยกตัวอย่างเช่น การละลายของสารประกอบไอออนิก
เมื่อให้สารประกอบไออออนิกละลายน้ำ จะเกิดการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้
ขั้นที่ 1 ของแข็งไอออนิกสลายตัวเป็นไอออนบวกและไอออนลบในสภาวะก๊าซ ขั้นนี้เป็นการเปลี่ยนแปลงประเภทดูดพลังงาน เพราะต้องใช้พลังงานเพื่อสลายแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบ พลังงานที่ใช้ในขั้นนี้ เรียกว่า พลังงานแลตทิช หรือพลังงานโครงร่างผลึก (Lattice Energy)
ขั้นที่ 2 ไอออนบวกและไอออนลบในภวะก๊าซรวมตัวกับโมเลกุลของน้ำ กลายเป็นไอออนที่ถูกไฮเดรต เนื่องจากขั้นนี้เกิดแรงยึดเหนี่ยวระหว่างไอออนบวกและไอออนลบกับโมเลกุลของน้ำ ขั้นนี้จึงเป็นการเปลี่ยนแปลงประเภทคายพลังงาน พลังงานที่คายออกมาเรียกว่า พลังงานไฮเดรชัน เช่น เมื่อโซเดียมคลอไรด์ละลายน้ำจะเกิดการเปลี่ยนแปลง 2 ขั้น ดังนี้

การละลายน้ำของสารประกอบไอออนิก อาจเป็นการเปลี่ยนแปลงประเภทดูดความร้อนหรือคายความร้อนก็ได้ ขึ้นอยู่กับค่าพลังงานแลตทิช และพลังงานไฮเดรชัน พิจารณาได้ดังนี้
1. ถ้าพลังงานแลตทิชมากกว่าพลังงานไฮเดรชัน การละลายน้ำของสารประกอบไอออนิกนั้นเป็นการเปลี่ยนแปลงประเภทดูดความร้อน
2.ถ้าพลังงานแลตทิชน้อยกว่าพลังงานไฮเดรชัน การละลายน้ำของสารประกอบไอออนิกนั้นเป็นการเปลี่ยนแปลงประเภทคายความร้อน
3.ถ้าพลังงานแลตทิชเท่ากับพลังงานไฮเดรชัน การละลายน้ำของสารประกอบไอออนิกนั้นไม่มีการเปลี่ยนแปลงพลังงาน
4.ถ้าพลังงานแลตทิชมากกว่าพลังงานไฮเดรชันมาก ๆ สารประกอบไอออนิกนั้นละลายน้ำได้น้อยมาก จนถึอว่าไม่ละลาย เหตุที่ไม่ละลายเพราะว่า แรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบแข็งแรงมาก โมเลกุลของน้ำจึงไม่สามารถดึงให้แยกออกจากันได้ หรือกล่าวได้ว่า แรงดึงดูดระหว่างไอออนบวกกับไอออนลบแข็งแรงกว่าแรงดึงดูดระหว่างไอออนกับโมเลกุลของน้ำมาก
เหตุที่ไม่ละลายเพราะว่า แรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบแข็งแรงมาก โมเลกุลของน้ำจึง
ไม่สามารถดึงให้แยกออกจากันได้ หรือกล่าวได้ว่า แรงดึงดูดระหว่างไอออนบวกกับไอออนลบแข็งแรงกว่าแรงดึงดูด
ระหว่างไอออนกับโมเลกุลของน้ำมาก

ความสามารถในการละลายน้ำของสารประกอบไอออนิก
จากการพิจารณาว่าเมื่อสารไอออนิกละลายในน้ำเป็นการละลายประเภทดูดหรือคายความร้อน นอกจากพิจารณาจากพลังงานแลตทิช และพลังงานไฮเดรชันดังกล่าวข้างต้นแล้ว ยังสามารถพิจารณาได้จากควาสามารถในการละลายของสารไอออนิกนั้นในน้ำดังนี้
1. สารไอออนิกใดละลายน้ำได้มากขึ้นเมื่ออุณหภูมิสูงขึ้น การละลายของสารไอออนิกนั้น เป็นการละลายประเภทดูดความร้อน
2. สารไอออนิกใดละลายน้ำได้น้อยลงเมื่ออุณหภูมิสูงขึ้น การละลายของสารไอออนิกนั้น เป็นการละลายประเภทคายความร้อน
สรุปกระบวนการละลายของตัวถูกละลายในตัวทำละลาย ประกอบด้วย
- การทำลายแรงยึดเหนี่ยว solvent - solvent และ solute - solute ----> Hdiss มีค่าบวก (ดูดพลังงาน)
- การเกิดแรงยึดเหนี่ยว solvent -solute ----> Hbind มีค่าลบ (คายพลังงาน)
- ความร้อนของการละลาย Hsoln= Hdiss +Hbind
ไม่มีความคิดเห็น:
แสดงความคิดเห็น