ตารางธาตุ
ตารางธาตุ (อังกฤษ: Periodic table) คือ ตารางที่ใช้แสดงรายชื่อธาตุเคมี ซึ่งจัดเรียงบนพื้นฐานของเลขอะตอม (จำนวนโปรตอนในนิวเคลียส) การจัดเรียงอิเล็กตรอน และสมบัติทางเคมี โดยจะเรียงตามเลขอะตอมที่เพิ่มขึ้น ซึ่งจะระบุไว้ในร่วมกับสัญลักษณ์ธาตุเคมี ในกล่องของธาตุนั้น ตารางธาตุมาตรฐานจะมี 18 หมู่และ 7 คาบ และมีคาบพิเศษเพิ่มเติมมาอยู่ด้านล่างของตารางธาตุ ตารางยังสามารถเปลี่ยนเป็นการจัดเรียงตามบล็อก โดย บล็อก-s จะอยู่ซ้ายมือ บล็อก-p จะอยู่ขวามือ บล็อก-d จะอยู่ตรงกลางและบล็อก-f อยู่ที่ด้านล่าง
แถวแนวนอนในตารางธาตุจะเรียกว่า คาบ และแถวในแนวตั้งเรียกว่า หมู่ โดยหมู่บางหมู่จะมีชื่อเฉพาะ เช่นแฮโลเจน หรือแก๊สมีตระกูล โดยคำนิยามของตารางธาตุ ตารางธาตุยังมีแนวโน้มของสมบัติของธาตุ เนื่องจากเราสามารถใช้ตารางธาตุบอกความสัมพันธ์ระหว่างสมบัติของธาตุแต่ละตัว และใช้ทำนายสมบัติของธาตุใหม่ ธาตุที่ยังไม่ถูกค้นพบ หรือธาตุที่สังเคราะห์ขึ้น และด้วยความพิเศษของตารางธาตุ ทำให้มันถูกใช้อย่างกว้างขวางในการศึกษาวิชาเคมีหรือวิทยาศาสตร์สาขาอื่น ๆ
ดมีตรี เมนเดเลเยฟ รู้จักกันในฐานะผู้ที่ตีพิมพ์ตารางธาตุในลักษณะแบบนี้เป็นคนแรก ใน พ.ศ. 2412 เขาจัดตารางธาตุโดยเรียงตามสมบัติทางเคมีของธาตุ และเมนเดเลเยฟยังสามารถทำนายธาตุที่ยังไม่ค้นพบ โดยเขาเชื่อว่ามันจะเติมเต็มช่องว่างในตารางธาตุของเขาได้ การทำนายของเขาส่วนใหญ่ค่อนข้างใกล้เคียงกับสมบัติจริงของธาตุ ตารางธาตุของเขาก็ขยายเพิ่มขึ้นด้วยการค้นพบธาตุใหม่เรื่อย ๆ และก็มีการพัฒนาแบบจำลองทางทฤษฎีที่ใช้อธิบายพฤติกรรมของธาตุเคมีใหม่ ๆ เหล่านั้น
ธาตุทุกตัวนับตั้งแต่มีเลขอะตอมเท่ากับ 1 (ไฮโดรเจน) จนถึง 118 (ออกาเนสซอน) ถูกค้นพบหรือมีการสังเคราะห์ขึ้นมาได้แล้ว ธาตุ 98 ตัวแรกพบได้ในธรรมชาติถึงแม้ว่าบางตัวจะมีปริมาณน้อย และถูกสังเคราะห์ขึ้นก่อนที่จะพบในธรรมชาติก็ตาม ส่วนธาตุที่มีเลขอะตอมเท่ากับ 99 ถึง 118 ถูกสังเคราะห์ขึ้นทั้งสิ้นหรือมีการคาดว่าจะถูกสังเคราะห์ ในห้องปฏิบัติการทางวิทยาศาสตร์ พบว่าไอน์สไตเนียมและเฟอร์เมียม สามารถพบในธรรมชาติได้ในเตาปฏิกรณ์นิวเคลียร์ธรรมชาติ ที่เมืองโอโคล ประเทศกาบอง แต่ปัจจุบันยังไม่มีการทำเช่นนั้น[1] การผลิตธาตุที่มีเลขอะตอมสูงกว่านี้กำลังมีการผลิตอย่างรวดเร็วกับคำถามที่ว่าตารางธาตุจะต้องมีการปรับเปลี่ยนรูปแบบเพื่อนรองรับธาตุใหม่ ๆ
| [ซ่อน] | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| หมู่ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| โลหะแอลคาไล | โลหะแอลคาไลน์เอิร์ท | นิกโทเจน | แชลโคเจน | แฮโลเจน | แก๊สมีตระกูล | |||||||||||||||||||||||||
| คาบ | ||||||||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||||||||
| 6 | ||||||||||||||||||||||||||||||
| 7 | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
ตารางธาตุทุกรูปแบบจะประกอบไปด้วยธาตุเคมีเท่านั้น ไม่มีสารผสม สารประกอบ หรืออนุภาคมูลฐาน[n 1] อยู่ในตารางธาตุด้วย ธาตุเคมีแต่ละตัวจะประกอบไปด้วยเลขอะตอม ซึ่งจะบ่งบอกจำนวนโปรตอนในนิวเคลียสของธาตุนั้น ๆ ธาตุส่วนใหญ่จะมีจำนวนนิวตรอนแตกต่างกัน ท่ามกลางอะตอมที่แตกต่างกัน ซึ่งจะอยู่ในรูปของไอโซโทป เช่น คาร์บอน มีไอโซโทปที่ปรากฏในธรรมชาติ 3 ไอโซโทป โดยไอโซโทปของคาร์บอนส่วนใหญ่ที่ปรากฏในธรรมชาติจะประกอบไปด้วยโปรตอน 6 ตัวและนิวตรอน 6 ตัว แต่มีเพียง 1 เปอร์เซ็นต์ที่จะมีนิวตรอน 7 ตัว และมีโอกาสนิดเดียวที่จะพบคาร์บอนที่มีนิวตรอน 8 ตัว ไอโซโทปแต่ละไอโซโทปจะไม่ถูกแยกออกจากกันในตารางธาตุ พวกมันถูกจัดให้เป็นธาตุเดียวกันไปเลย ธาตุที่ไม่มีไอโซโทปที่เสถียรจะสามารถหามวลอะตอมได้จากไอโซโทปที่เสถียรที่สุดของมัน โดยมวลอะตอมที่เสถียรที่สุดดังกล่าวจะแสดงในวงเล็บ[2]
ในตารางธาตุมาตรฐาน ธาตุจะถูกเรียงตามเลขอะตอม (จำนวนโปรตอนในนิวเคลียสของอะตอม) ที่เพิ่มขึ้น คาบใหม่จะมีได้ก็ต่อเมื่อวงอิเล็กตรอนใหม่มีอิเล็กตรอนอยู่ในวงอย่างน้อยหนึ่งตัว หมู่จะกำหนดตามการจัดเรียงอิเล็กตรอนของอะตอม ธาตุที่มีจำนวนอิเล็กตรอนเดียวกันในวงอิเล็กตรอนชั้นนอกสุดจะถูกจัดให้อยู่ในหมู่เดียวกัน (เช่น ออกซิเจน กับซีลีเนียม อยู่ในหมู่เดียวกันเพราะว่าพวกมันมีอิเล็กตรอน 4 ตัวในวงอิเล็กตรอนชั้นนอกสุดเหมือนกัน) โดยทั่วไป ธาตุที่สมบัติทางเคมีคล้ายกันจะถูกจัดในหมู่เดียวกัน ถึงแม้จะเป็นในบล็อก-f ก็ตาม และธาตุบางตัวในบล็อก-d มีธาตุที่มีสมบัติเหมือนกันในคาบเดียวกันเช่นกัน ดังนั้นจึงเป็นเรื่องง่ายที่จะทำนายสมบัติทางเคมีของธาตุเหล่านั้น ถ้ารู้ว่าธาตุรอบ ๆ นั้นมีคุณสมบัติอย่างไร[3]
จนถึง พ.ศ. 2559 ตารางธาตุมีธาตุที่ได้รับการยืนยันแล้ว 118 ตัว ตั้งแต่ธาตุที่ 1 (ไฮโดรเจน) ถึงธาตุที่ 118 (ออกาเนสซอน)[4]
ธาตุทั้งหมด 98 พบได้ในธรรมชาติ อีก 16 ธาตุที่เหลือ นับตั้งแต่ ธาตุที่ 99 (ไอน์สไตเนียม) จนถึงธาตุที่ 118 (ออกาเนสซอน) ถูกสังเคราะห์ขึ้นในห้องปฏิบัติการทางวิทยาศาสตร์เท่านั้น ในบรรดาธาตุ 98 ตัวที่พบในธรรมชาตินี้ มีธาตุ 84 ตัวที่เป็นธาตุดึกดำบรรพ์ และที่เหลืออีก 14 ธาตุปรากฏในโซ่ของการสลายตัวของธาตุดึกดำบรรพ์เหล่านั้น[1] ยังไม่มีใครพบธาตุที่หนักกว่าไอน์สไตเนียม (ธาตุที่ 99) ในรูปธาตุบริสุทธิ์ ในปริมาณที่มองเห็นได้ด้วยตาเปล่าเลย[5]
การแบ่งตารางธาตุ[แก้]
| Periodic table layouts | |
|---|---|
| แลนทาไนด์และแอกทิไนด์แยกออกจากตารางธาตุหลัก (ซ้ายมือ) และอยู่ในตารางธาตุหลัก (ขวามือ) | |
ในการนำเสนอตารางธาตุผ่านทางกราฟิกนั้น ตารางธาตุหลักจะมี 18 หมู่ และมีหมู่แลนทาไนด์และแอกทิไนด์แยกออกมาอยู่ด้านล่างของตารางธาตุหลัก[6] ซึ่งจะเป็นช่องว่างในตารางธาตุระหว่างแบเรียมกับแฮฟเนียม และระหว่างเรเดียม กับรัทเทอร์ฟอร์เดียม ตามลำดับ โดยธาตุเหล่านี้จะมีเลขอะตอมระหว่าง "51 – 71" และตารางธาตุอีกลักษณะหนึ่ง คือตารางธาตุ 32 หมู่ ซึ่งจะนำหมู่แลนทาไนด์และแอกทิไนด์เข้ามาอยู่ในตารางธาตุหลักด้วย โดยจะอยู่ในคาบที่ 6 กับคาบที่ 7
ถึงอย่างนั้น มีการสร้างตารางธาตุรูปแบบอื่น ๆ ขึ้นมา โดยยึดพื้นฐานของสมบัติทางกายภาพและสมบัติทางเคมีของธาตุด้วย
การจัดเรียงธาตุในตารางธาตุ[แก้]
หมู่[แก้]
ดูบทความหลักที่: หมู่ (ตารางธาตุ)
หมู่ เป็นแถวแนวตั้งในตารางธาตุ หมู่ยังถูกใช้เพื่อตรวจสอบแนวโน้มของธาตุ ซึ่งเห็นชัดได้กว่าคาบหรือบล็อก ทฤษฎีควอนตัมของอะตอมได้อธิบายว่าธาตุในหมู่เดียวกันมีสมบัติทางเคมีเหมือนกัน เนื่องจากมีการจัดเรียงอิเล็กตรอนที่เหมือนกันในวงวาเลนซ์ของมัน[7] ดังนั้นธาตุในหมู่เดียวกันมักจะมีสมบัติทางเคมีที่ชัดเจนขึ้นเมื่อเลขอะตอมมากขึ้น[8] ถึงอย่างนั้น บางส่วนของตารางธาตุก็ไม่ได้เป็นไปตามนี้ เช่นธาตุในบล็อก-d หรือบล็อก-f[9][10][11]
ภายใต้การตั้งชื่ออย่างเป็นทางการหมู่ที่มีเลข 1 ถึง 18 จากฝั่งซ้ายสุด (โลหะแอลคาไล) มายังฝั่งขวาสุด (แก๊สมีตระกูล) [12] ก่อนหน้านั้นพวกมันรู้จักในรูปแบบของเลขโรมัน ในสหรัฐอเมริกา เลขโรมันเหล่านี้ตามด้วยอักษร "A" เมื่อหมู่นั้นอยู่ในบล็อก-s หรือ p และตามด้วยอักษร "B" เมื่อหมู่นั้นอยู่ในบล็อก-d เลขโรมันใช้เพื่อต่อท้ายเลขตัวสุดท้ายที่บอกหมู่ (เช่น ธาตุหมู่ 4 เป็น IVB และธาตุหมู่ 14 เป็น IVA) ในยุโรป การแบ่งในลักษณะนี้มีขึ้นเหมือนกัน ยกเว้นหมู่ที่ใช้อักษร "A" จะใช้เมื่อเป็นหมู่ที่ 10 ลงมา และ "B" จะใช้เมื่อเป็นหมู่ที่ 10 และหมู่ที่ 10 ขึ้นไป นอกจากนี้หมู่ที่ 8 9 และ 10 เป็นหมู่ที่มีขนาดใหญ่กว่าหมู่อื่น ๆ 3 เท่า โดยทั้งหมดมีชื่อหมู่ว่า VIII แต่ใน พ.ศ. 2531 ระบบการตั้งชื่อใหม่ของไอยูแพกก็เกิดขึ้นและการตั้งชื่อหมู่แบบเก่าก็ถูกยกเลิกไป[13]
ธาตุในหมู่เดียวกันจะมีความคล้ายคลึงกันในรัศมีอะตอม พลังงานไอออไนเซชัน และอิเล็กโทรเนกาติวิตี จากธาตุบนสุดของหมู่ลงมาถึงธาตุล่างสุดของหมู่ รัศมีอะตอมจะเพิ่มขึ้นเนื่องจากมีระดับพลังงานและวาเลนซ์อิเล็กตรอนที่เพิ่มขึ้น โดยมันจะอยู่ห่างจากนิวเคลียสเพิ่มขึ้นด้วยเช่นกัน ในส่วนของพลังงานไอออไนเซชัน ธาตุในหมู่เดียวกันจะมีพลังงานไอออไนเซชันที่คล้ายกัน แต่ธาตุในคาบเดียวกันจากซ้ายไปขวาจะมีพลังงานไอออไนเซชันเพิ่มขึ้น เนื่องจากมันง่ายที่จะดึงอิเล็กตรอนออกไป เนื่องจากอะตอมไม่มีพันธะระหว่างอิเล็กตรอนที่แน่นหนา เช่นเดียวกันอิเล็กโทรเนกาติวิตีจะเพิ่มขึ้นจากบนลงล่าง เนื่องจากธาตุที่อยู่ล่างกว่ามีระยะห่างระหว่างนิวเคลียสกับวาเลนซ์อิเล็กตรอนมากกว่าธาตุที่อยู่ด้านบน[14] แต่ก็ยังมีข้อยกเว้น เช่น ในหมู่ 11 สัมพรรคภาพอิเล็กตรอนจะมีการเพิ่มขึ้นจากล่างขึ้นบน[15]
คาบ[แก้]
ดูบทความหลักที่: คาบ (ตารางธาตุ)
คาบ เป็นแถวในแนวนอนของตารางธาตุ ถึงแม้ว่าหมู่จะบอกแนวโน้มของธาตุเคมีที่สำคัญ แต่ก็ยังมีบางที่ที่แนวโน้มตามคาบจะสำคัญกว่า เช่น บล็อก-f ที่ซึ่งแลนทาไนด์และแอกทิไนด์มีสมบัติทางเคมีเพิ่มขึ้นจากซ้ายไปขวา[16]
ธาตุในคาบเดียวกันจะมีความคล้ายคลึงกันในรัศมีอะตอม พลังงานไอออไนเซชัน สัมพรรคภาพอิเล็กตรอน และอิเล็กโทรเนกาติวิตี จากซ้ายไปขวา ส่วนใหญ่รัศมีอะตอมของธาตุจะค่อย ๆ ลดลง เนื่องจากธาตุที่อยู่ถัดไปมีจำนวนโปรตอนและอิเล็กตรอนเพิ่มขึ้น ซึ่งทำให้อิเล็กตรอนอยู่ใกล้นิวเคลียสมากขึ้น[17] และผลจากการที่รัศมีอะตอมลดลง ทำให้พลังงานไอออไนเซชันเพิ่มขึ้น จากซ้ายไปขวา เนื่องจากอะตอมของธาตุนั้นมีพันธะระหว่างอิเล็กตรอนที่แน่นขึ้น ทำให้ต้องใช้พลังงานที่มากขึ้นในการดึงอิเล็กตรอนออก ส่วนอิเล็กโทรเนกาติวิตีจะเพิ่มขึ้นในลักษณะเดียวกันกับพลังงานไอออไนเซชัน เพราะมีแรงดึงของนิวเคลียสที่กระทำต่ออิเล็กตรอนมากขึ้น[14] ส่วนสัมพรรคภาพอิเล็กตรอน ธาตุโลหะ (ฝั่งซ้ายในตารางธาตุ) โดยส่วนใหญ่จะมีสัมพรรคภาพอิเล็กตรอนน้อยกว่าธาตุอโลหะ (ฝั่งขวาในตารางธาตุ) ยกเว้นแก๊สมีตระกูลซึ่งไม่มีสัมพรรคภาพอิเล็กตรอน[18]
บล็อก[แก้]
ดูบทความหลักที่: บล็อกในตารางธาตุ
บล็อก เป็นบริเวณพิเศษในตารางธาตุ ซึ่งจะบ่งบอกว่าอิเล็กตรอนในวงอิเล็กตรอนแต่ละวงเต็มหรือไม่ ในแต่ละบล็อกจะตั้งชื่อตามวงย่อยที่อิเล็กตรอน "ตัวสุดท้าย" สามารถเข้าไปอยู่ได้[19][n 2]บล็อก-s เป็นบล็อกที่อยู่ทางซ้ายมือสุดในตารางธาตุ บล็อกนี้ประกอบไปด้วยธาตุในหมู่ 1 (โลหะแอลคาไล) และหมู่ 2 (โลหะแอลคาไลน์เอิร์ท) รวมถึงไฮโดรเจน และฮีเลียม บล็อก-p เป็นบล็อกที่อยู่ทางขวาสุดของตารางธาตุ ประกอบไปด้วยธาตุใน 6 หมู่สุดท้าย ตั้งแต่หมู่ที่ 13 ถึง หมู่ที่ 18 ในไอยูแพก (3B ถึง 8A ในสหรัฐอเมริกา) และยังมีธาตุกึ่งโลหะทั้งหมดในบล็อกนี้ด้วย บล็อก-d เป็นบล็อกที่ประกอบไปด้วยธาตุในหมู่ 3 ถึง หมู่ที่ 12 (3B ถึง 2B ในสหรัฐอเมริกา) ธาตุในบล็อกนี้เป็นธาตุโลหะแทรนซิชันทั้งหมด บล็อก-f เป็นบล็อกที่ไม่มีเลขหมู่ และอยู่ด้านล่างของตารางธาตุ ในบล็อกนี้ประกอบไปด้วยธาตุในแลนทาไนด์และแอกทิไนด์[20]
ความเป็นโลหะ[แก้]
ตามสมบัติทางกายภาพและทางเคมีของมัน เรายังสามารถแบ่งธาตุออกได้เป็นสามส่วนใหญ่ ๆ ได้แก่ โลหะ กึ่งโลหะ และอโลหะ ธาตุโลหะส่วนใหญ่จะสะท้อนแสง อยู่ในรูปอัลลอย และยังสามารถทำปฏิกิริยากับธาตุอโลหะ (ยกเว้น แก๊สมีตระกูล) ได้สารประกอบไอออนิกในรูปของเกลือ ส่วนธาตุอโลหะส่วนใหญ่จะเป็นแก๊สซึ่งไม่มีสีหรือมีสี อโลหะที่ทำปฏิกิริยากับอโลหะด้วยกันจะทำให้เกิดสารประกอบที่มีพันธะโควาเลนต์ ระหว่างธาตุโลหะกับธาตุอโลหะ คือธาตุกึ่งโลหะ ซึ่งจะมีสมบัติของธาตุโลหะและอโลหะผสมกัน[21]
โลหะและอโลหะยังสามารถแบ่งย่อยออกไปอีกตามความเป็นโลหะ จากซ้ายไปขวาในตารางธาตุ โลหะยังแบ่งย่อยไปเป็นโลหะแอลคาไลที่มีความว่องไวในการทำปฏิกิริยาสูง โลหะแอลคาไลน์-เอิร์ทที่มีความว่องไวในการทำปฏิกิริยารองลงมา แลนทาไนด์และแอกทิไนด์ โลหะแทรนซิชัน และจบที่โลหะหลังแทรนซิชันซึ่งมีความเป็นโลหะน้อยที่สุดในบรรดาโลหะด้วยกัน ส่วนอโลหะแบ่งออกเป็นอโลหะหลายวาเลนซ์ ซึ่งจะอยู่ใกล้กับตำแหน่งของธาตุกึ่งโลหะ มีสมบัติบางประการที่คล้ายกับโลหะ และอโลหะวาเลนซ์เดียว ซึ่งเป็นอโลหะหลัก และแก๊สมีตระกูล ซึ่งเป็นธาตุที่เสถียรแล้ว และในโลหะแทรนซิชันยังมีการแบ่งออกไปอีก เช่น โลหะมีสกุลและ โลหะทนไฟ และธาตุย่อยในโลหะเหล่านี้ (ในตัวอย่าง) เป็นที่รู้จักแล้ว[22] และยังมีการกล่าวถึงเป็นครั้งคราว[23]
แนวโน้มพิริออดิก[แก้]
การจัดเรียงอิเล็กตรอน[แก้]
ดูบทความหลักที่: การจัดเรียงอิเล็กตรอน
การจัดเรียงอิเล็กตรอนเป็นส่วนหนึ่งที่ทำให้เราสามารถจัดธาตุในตารางธาตุได้ เพราะจากซ้ายไปขวาตามคาบ อิเล็กตรอนจะเพิ่มขึ้น อิเล็กตรอนจะเข้าไปอยู่ในวงอิเล็กตรอน (วงที่ 1 วงที่ 2 และอื่น ๆ) แต่ละวงก็ประกอบไปด้วยวงย่อยหนึ่งวงหรือมากกว่านั้น (มีชื่อว่า s p d f และ g) เมื่อเลขอะตอมของธาตุมากขึ้น อิเล็กตรอนจะเข้าไปอยู่ในวงย่อยตามกฎของแมนเดลัง เช่นการจัดเรียงอิเล็กตรอนของนีออน คือ 1s2 2s2 2p6 ด้วยเลขอะตอมเท่ากับ 10 นีออนมีอิเล็กตรอน 2 ตัวในวงอิเล็กตรอนแรก และมีอิเล็กตรอนอีก 8 ตัวในวงอิเล็กตรอนที่สอง โดยแบ่งเป็นในวงย่อย s 2 ตัวและในวงย่อย p 6 ตัว ในส่วนของตารางธาตุ เมื่ออิเล็กตรอนตัวหนึ่งไม่สามารถไปอยู่ในวงอิเล็กตรอนที่สองได้แล้ว มันก็จะเข้าไปอยู่ในวงอิเล็กตรอนใหม่ และธาตุนั้นก็จะถูกจัดให้อยู่ในคาบถัดไป ซึ่งตำแหน่งเหล่านี้เป็นธาตุไฮโดรเจน และธาตุในหมู่โลหะแอลคาไล[24][25]
รัศมีอะตอม[แก้]
ดูบทความหลักที่: รัศมีอะตอม
รัศมีอะตอมของธาตุแต่ละตัวมีความแตกต่างในการทำนายและอธิบายในตารางธาตุ ยกตัวอย่างเช่น รัศมีอะตอมทั่วไปลดลงไปตามหมู่ของตารางธาตุจากโลหะแอลคาไลถึงแก๊สมีตระกูล และจะเพิ่มขึ้นรวดเร็วจากแก๊สมีตระกูลมายังโลหะแอลคาไลในจุดเริ่มต้นของคาบถัดไป แนวโน้มเหล่านี้ของรัศมีอะตอม (และสมบัติทางเคมีและทางกายภาพของธาตุอื่น ๆ) สามารถอธิบายได้โดยทฤษฎีวงอิเล็กตรอนของอะตอม พวกมันมีหลักฐานสำคัญสำหรับการพัฒนาทฤษฎีควอนตัม[26]
อิเล็กตรอนในวงย่อย 4f ซึ่งจะถูกเติมเต็มตั้งแต่ซีเรียม (ธาตุที่ 58) ถึงอิตเตอร์เบียม (ธาตุที่ 70) เนื่องด้วยอิเล็กตรอนเพิ่มขึ้นแค่ในวงเดียว จึงทำให้ขนาดอะตอมของธาตุในแลนทาไนด์มีขนาดที่ไม่แตกต่างกัน และอาจจะเหมือนกับธาตุตัวถัด ๆ ไป ด้วยเหตุนี้ทำให้แฮฟเนียมมีรัศมีอะตอม (และสมบัติทางเคมีอื่น ๆ) เหมือนกับเซอร์โคเนียม และแทนทาลัม มีรัศมีอะตอมใกล้เคียงกับไนโอเบียม ลักษณะแบบนี้รู้จักกันในชื่อการหดตัวของแลนทาไนด์ และผลจากการหดตัวของแลนทาไนด์นี้ ยังเห็นได้ชัดไปจนถึงแพลตทินัม (ธาตุที่ 78) และการหดตัวที่คล้าย ๆ กัน คือการหดตัวของบล็อก-d ซึ่งมีผลกับธาตุที่อยู่ระหว่างบล็อก-d และบล็อก-p มันเห็นได้ไม่ชัดเจนเท่าการหดตัวของแลนทาไนด์ แต่เกิดจากสาเหตุเดียวกัน[27]
พลังงานไอออไนเซชัน[แก้]
ดูบทความหลักที่: พลังงานไอออไนเซชัน
พลังงานไอออไนเซชันลำดับที่ 1 เป็นพลังงานที่ใช้ดึงอิเล็กตรอนตัวแรกออกจากอะตอม พลังงานไอออไนเซชันลำดับที่สอง เป็นพลังงานที่ใช้ดึงอิเล็กตรอนตัวที่สองออกจากอะตอม ซึ่งจะเป็นแบบนี้ไปเรื่อย ๆ เช่น แมงกานีส มีพลังงานไอออไนเซชันลำดับที่ 1 คือ 738 กิโลจูล/โมล และลำดับที่สอง คือ 1450 กิโลจูล/โมล อิเล็กตรอนที่อยู่ใกล้อะตอมจำเป็นที่จะต้องใช้พลังงานมากในการดึงมันออกจากอะตอม พลังงานไอออไนเซชันจะมีการเพิ่มขึ้นจากซ้ายไปขวาของตารางธาตุ[28]
พลังงานไอออไนเซชันจะมีมากที่สุดเมื่อต้องการดึงอิเล็กตรอนออกจากธาตุในหมู่แก๊สมีตระกูล (ซึ่งมีอิเล็กตรอนครบตามจำนวนที่มีได้สูงสุด) ยกตัวอย่างแมกนีเซียมอีกครั้ง แมกนีเซียมจำเป็นที่จะต้องใช้พลังงานไอออไนเซชันสองลำดับแรก เพื่อดึงอิเล็กตรอนออกให้มันมีโครงสร้างคล้ายแก๊สมีตระกูล และ 2p มันจำเป็นที่จะต้องใช้พลังงานไอออไนเซชันลำดับที่สามสูงกว่า 7730 กิโลจูล/โมล ในการดึงอิเล็กตรอนตัวที่สามออกจากวงย่อย 2p ของการจัดเรียงอิเล็กตรอนที่คล้ายนีออนของ Mg2+ ความแตกต่างนี้ยังมีในอะตอมของแถวที่สามตัวอื่น ๆ อีกด้วย[28]
อิเล็กโทรเนกาติวิตี[แก้]
ดูบทความหลักที่: อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตีเป็นแรงดึงดูดของอะตอมที่ใช้ดึงอิเล็กตรอนเข้ามา[29] อิเล็กโทรเนกาติวิตีของอะตอมอะตอมหนึ่ง เป็นผลมาจากเลขอะตอมที่เพิ่มขึ้น และระยะห่างจากนิวเคลียสถึงวาเลนซ์อิเล็กตรอน ยิ่งมีอิเล็กโทรเนกาติวิตีมากเท่าไร ความสามารถที่จะดึงดูดอิเล็กตรอนก็มากขึ้นเท่านั้น แนวคิดถูกเสนอครั้งแรกโดยไลนัส พอลลิง ใน พ.ศ. 2475[30] โดยทั่วไป อิเล็กโทรเนกาติวิตีจะเพิ่มขึ้นจากซ้ายไปขวาตามคาบ และลดลงจากบนลงล่างตามหมู่ เพราะเหตุนี้ ฟลูออรีนจึงเป็นธาตุที่มีอิเล็กโทรเนกาติวิตีสูงที่สุด และซีเซียมมีอิเล็กโทรเนกาติวิตีน้อยที่สุด อย่างน้อยธาตุเหล่านั้นก็ยังมีข้อมูลที่สามารถใช้ยืนยันได้[15]
แต่ถึงกระนั้นธาตุบางตัวยังไม่เป็นไปตามกฎนี้ แกลเลียมและเจอร์เมเนียมมีอิเล็กโทรเนกาติวิตีมากกว่าอะลูมิเนียมและซิลิกอน เนื่องด้วยผลกระทบจากการหดตัวของบล็อก-d ธาตุในคาบที่ 4 ในส่วนของโลหะแทรนซิชัน มีรัศมีอะตอมที่ไม่แตกต่างกันมากนัก เพราะว่าอิเล็กตรอนในวงย่อย 3d ไม่มีผลกระทบต่อการเปลี่ยนแปลงโครงสร้างนิวเคลียร์ของธาตุ และขนาดอะตอมที่เล็กลงยังทำให้มีอิเล็กโทรเนกาติวิตีสูงขึ้นอีกด้วย[15][31]
สัมพรรคภาพอิเล็กตรอน[แก้]
สัมพรรคภาพอิเล็กตรอนเป็นพลังงานที่คายออกมาหรือดูดกลืน เมื่อเพิ่มอิเล็กตรอนให้แก่อะตอมไปเป็นไอออนประจุลบ ธาตุส่วนใหญ่คายพลังงานความร้อนเมื่อรับอิเล็กตรอน โดยทั่วไป อโลหะจะมีสัมพรรคภาพอิเล็กตรอนมากกว่าโลหะ คลอรีน มีแนวโน้มในการเกิดไอออนประจุลบสูงที่สุด สัมพรรคภาพอิเล็กตรอนของแก๊สมีตระกูลยังไม่สามารถหาค่าได้ ดังนั้น พวกมันอาจจะไม่มีประจุลบ[34]
สัมพรรคภาพอิเล็กตรอนทั่วไปจะเพิ่มขึ้นตามคาบ ซึ่งเป็นผลมาจากการเติมเต็มวงเวเลนซ์ของอะตอม อะตอมของธาตุหมู่ 17จะคายพลังงานออกมามากกว่าอะตอมของธาตุในหมู่ 1 ในการดึงดูดอิเล็กตรอน เนื่องด้วยความง่ายในการเติมเต็มวงวาเลนซ์และความเสถียร[34]
ในหมู่ของธาตุ สัมพรรคภาพอิเล็กตรอนคาดว่าจะลดลงจากบนลงล่าง เนื่องด้วยอิเล็กตรอนตัวใหม่จะต้องเข้าไปในออร์บิทัลที่อยู่ห่างจากนิวเคลียสมากขึ้น ด้วยความที่อิเล็กตรอนเชื่อมของนิวเคลียสน้อยอยู่แล้ว จึงทำให้มันปล่อยพลังงานไม่มาก ถึงกระนั้น ในหมู่ของธาตุ ธาตุสามตัวแรกจะผิดปกติ ธาตุที่หนักกว่าจะมีสัมพรรคภาพอิเล็กตรอนมากกว่าธาตุที่เบากว่า และในวงย่อย d และ f สัมพรรคภาพอิเล็กตรอนจะไม่ได้ลดลงตามหมู่ไปเสียทั้งหมด ดังนั้นการที่สัมพรรคภาพลดลงตามหมู่จากบนลงล่างนี้ จะเกิดขึ้นได้ในอะตอมของธาตุหมู่ 1 เท่านั้น[35]
ประวัติของตารางธาตุ[แก้]
ดูบทความหลักที่: ประวัติของตารางธาตุ
ความพยายามในการวางระบบครั้งแรก[แก้]
ใน พ.ศ. 2332 อองตวน ลาวัวซิเอ ตีพิมพ์รายชื่อธาตุเคมี 33 ตัว เขาแบ่งเป็นแก๊ส โลหะ อโลหะ และเอิร์ท[36] นักเคมีใช้เวลาข้ามศตวรรษเพื่อค้นหาวิธีที่จะจัดระบบของธาตุเหล่านี้ ใน พ.ศ. 2372 โยฮันน์ ว็อล์ฟกัง เดอเบอไรเนอร์ สังเกตว่าธาตุจำนวนมากนั้นสามารถจัดลงในไตรแอดส์ โดยอยู่บนพื้นฐานของสมบัติทางเคมีของมันได้ เช่น ลิเทียม โซเดียม และโพแทสเซียม พวกมันถูกจัดให้อยู่ในกลุ่มเดียวกัน เนื่องจากเป็นโลหะที่อ่อน และไวต่อการเกิดปฏิกิริยา เดอเบอไรเนอร์ยังสังเกตอีกว่ามวลอะตอมของธาตุตัวที่สองในไตรแอดส์ของเขานั้น เป็นค่าเฉลี่ยของมวลอะตอมธาตุที่หนึ่งและธาตุที่สาม ซึ่งรู้จักกันในภายหลังว่า กฎไตรแอดส์[37] นักเคมีชาวเยอรมัน เลโอโปลด์ กเมลิน ทำงานด้วยระบบไตรแอดส์นี้ และใน พ.ศ. 2386 เขาก็ค้นพบ ไตรแอดส์สิบตัว โดยมี 3 กลุ่มที่มี 4 ธาตุและอีก 1 กลุ่มที่มี 5 ธาตุ ฌอง-บัฟติส ดูมัส ตีพิมพ์ผลงานเมื่อ พ.ศ. 2400 ซึ่งบรรยายความสัมพันธ์ระหว่างกลุ่มของโลหะบางกลุ่ม ถึงแม้ว่านักเคมีบางคนจะสามารถบรรยายถึงความสัมพันธ์ระหว่างกลุ่มธาตุขนาดเล็กได้แล้ว แต่พวกเขาก็ไม่ได้ทำให้มันครอบคลุมทั้งหมด[38]
ใน พ.ศ. 2401 นักเคมีชาวเยอรมัน ออกุสต์ คีคูเล สังเกตว่าคาร์บอนส่วนใหญ่มักจะอยู่ในรูปของอะตอมสี่ตัวทำพันธะต่อกัน เช่น มีเทน ซึ่งมีอะตอมคาร์บอน 1 ตัวและอะตอมของไฮโดรเจน 4 ตัว แนวคิดในลักษณะนี้ภายหลังรู้จักกันว่าเป็นเวเลนซ์ ซึ่งระบุไว้ว่าพันธะของธาตุต่างชนิดกันก็มีจำนวนอะตอมต่างกันด้วย[39]
ใน พ.ศ. 2405 นักธรณีวิทยาชาวฝรั่งเศส อเล็กซานเดอร์-เอมิล เบอกูเยร์ เดอ ชานกูร์ตัว ตีพิมพ์ตารางธาตุฉบับแรก ซึ่งเขาเรียกมันว่าเทลลูริก เฮลิกซ์ หรือสครู เขาเป็นคนแรกที่ทราบถึงความเป็นลำดับคาบของธาตุเคมี โดยการนำธาตุมาจัดเรียงเป็นวงก้นหอย หรือเป็นทรงกระบอกโดยเรียงตามมวลอะตอมที่เพิ่มขึ้น เดอ ชานกูร์ตัว แสดงให้เห็นว่าธาตุที่สมบัติทางเคมีเหมือนกันจะอยู่ใกล้กัน ตารางของเขายังมีไอออนและสารประกอบบางชนิดรวมอยู่ด้วย แผ่นกระดาษของเขามักจะถูกใช้ในทางธรณีวิทยามากกว่าทางเคมี และไม่รวมแผนภาพ และเป็นผลทำให้ได้รับความสนใจน้อยจนถึงผลงานของดมีตรี เมนเดเลเยฟ[40]
ใน พ.ศ. 2407 นักเคมีชาวเยอรมัน ยูลิอุส โลทาร์ ไมเออร์ ได้ตีพิมพ์ตารางธาตุซึ่งประกอบไปด้วยธาตุ 44 ตัวโดยเรียงตามความเป็นวาเลนซ์ ตารางของเขาแสดงให้เห็นว่าธาตุที่มีสมบัติทางเคมีเหมือนกันนั้น บ่อครั้งที่จะมีความเป็นวาเลนซ์ที่เหมือนกันด้วย ในเวลาที่ไล่เลี่ยกัน นักเคมีชาวอังกฤษ วิลเลียม โอดลิง ตีพิมพ์การจัดเรียงธาตุ 57 ตัว โดยเรียงบนพื้นฐานของมวลอะตอม ด้วยความที่ไม่ปกติและยังมีช่องว่าง เขาทราบว่าสิ่งที่เกิดขึ้นกับธาตุเป็นลำดับการเกิดคาบของมวลอะตอม และเขายังบันทึกไว้ว่า "มันมักจะได้รับการจัดกลุ่ม" [41] โอดลิงได้พูดถึงเกี่ยวกับความคิดในเรื่องของกฎพิริออดิก แต่เขาก็ไม่ได้สนใจมัน[42] ต่อมาเขาก็ได้นำเสนอ (ใน พ.ศ. 2413) การจัดหมวดหมู่บนพื้นฐานของความเป็นวาเลนซ์[43]
นักเคมีชาวอังกฤษ จอห์น นิวแลนส์ ได้ตีพิมพ์ผลงานของเขาในช่วง พ.ศ. 2406 – พ.ศ. 2409 ซึ่งมีหมายเหตุไว้ว่าเขาจัดธาตุตามมวลอะตอมที่เพิ่มขึ้น แล้วเขาก็พบว่าธาตุทุก ๆ 8 ตัวจะมีสมบัติทางกายภาพและสมบัติทางเคมีเหมือนกัน เขาคิดว่ามันเหมือนกับอ็อกเทฟในดนตรี[44][45] เขาจึงตั้งกฎขึ้นมา ซึ่งเรียกกันว่า กฎออกเทฟส์ ถึงอย่างนั้นสมาคมเคมีก็ปฏิเสธที่จะยอมรับงานของนิวแลนส์ เนื่องจากนิวแลนส์ได้ผลักดันธาตุให้เข้ากับกฎออกเทฟส์และไม่เว้นช่องว่างไว้ให้ธาตุที่ยังไม่ค้นพบ เช่น เจอร์เมเนียม[46] สมาคมเคมีรับทราบเพียงแค่การค้นพบของเขา จนกระทั่ง เมนเดเลเยฟตีพิมพ์ตารางธาตุของเขาออกมา[47]
ใน พ.ศ. 2410 นักเคมีชาวเดนมาร์ก กุสตาวุส ฮินริชส์ ได้ตีพิมพ์ตารางธาตุในลักษณะก้นหอยออกมาโดยจัดตามสเปกตรัมและมวลของอะตอม ผลงานของเขาได้รับยกย่องว่าเป็นผลงานที่พิสดาร โอ้อวด และซับซ้อน นี่เองที่อาจทำให้ไม่เป็นที่จดจำและเป็นที่ยอมรับ[48][49]
ตารางธาตุของเมนเดเลเยฟ[แก้]
นักเคมีชาวรัสเซีย ดมีตรี เมนเดเลเยฟ และนักเคมีชาวเยอรมัน ยูลิอุส โลทาร์ ไมเออร์ ได้ตีพิมพ์ตารางธาตุใน พ.ศ. 2412 และ พ.ศ. 2413 ตามลำดับ[50] ตารางธาตุของเมนเดเลเยฟเป็นการตีพิมพ์ครั้งแรกของเขา ส่วนของไมเออร์เป็นการเพิ่มเติมจากตารางธาตุเก่าของเขา ที่เคยตีพิมพ์เมื่อ พ.ศ. 2407[51] ตารางธาตุของทั้งสองสร้างขึ้นโดยจัดธาตุไว้เป็นคาบและหมู่โดยเรียงตามมวลอะตอม และจะเริ่มแถวใหม่เมื่อธาตุมีสมบัติทางเคมีที่เหมือนกัน[52]
สาเหตุที่ตารางธาตุของเมนเดเลเยฟได้รับการยอมรับมีอยู่สองประการ คือ หนึ่ง ตารางธาตุของเขามีช่องว่างไว้เพื่อให้ธาตุที่ยังไม่ได้รับการค้นพบ[53] เมนเดเลเยฟไม่ได้เป็นนักเคมีคนแรกที่ทำแบบนี้ แต่เขาเป็นคนแรกที่ได้รับการยอมรับในการใช้แนวโน้มในตารางธาตุ เพื่อทำนายสมบัติทางเคมีของธาตุที่ยังไม่ได้ค้นพบเหล่านั้น เช่น แกลเลียม และเจอร์เมเนียม[54] และเหตุผลที่สองคือบางครั้งเขาไม่ได้เรียงตามมวลอะตอมโดยทั้งหมด เขาสลับตำแหน่งธาตุบางตัว เช่น เทลลูเรียมและไอโอดีน โดยเขาให้เหตุผลว่าเพื่อให้ง่ายต่อการจัดธาตุลงไปในหมู่ของธาตุ กับการพัฒนาทฤษฎีโครงสร้างอะตอม ทำให้เป็นที่แน่ชัดแล้วว่า เมนเดเลเยฟ ไม่ได้ตั้งใจที่จะระบุไปว่า เขาจัดเรียงธาตุตามมวลอะตอมที่เพิ่มขึ้น หรือโครงสร้างนิวเคลียร์[55]
ความสำคัญของเลขอะตอมในการเป็นองค์ประกอบของตารางธาตุยังคงไม่ได้รับการยอมรับจนกระทั่งสมบัติของโปรตอนและนิวตรอนกลายเป็นที่รู้จักมากขึ้น ตารางธาตุของเมนเดเลเยฟก็ยังคงใช้มวลอะตอมแทนที่จะเป็นเลขอะตอม ซึ่งในเวลานั้นข้อมูลเกี่ยวกับมวลอะตอมมีความแม่นยำสูงสุด มวลอะตอมสามารถอธิบายถึงสมบัติทางเคมีของธาตุที่ยังไม่ค้นพบได้อย่างแม่นยำกว่าวิธีอื่น ๆ ที่รู้จักกันในเวลานั้น และวิธีนี้ก็ยังคงใช้ในการทำนายสมบัติของธาตุเคมีที่สังเคราะห์ขึ้นใหม่จนกระทั่งปัจจุบัน[56]
ตารางธาตุรุ่นที่สองและการพัฒนาหลังจากนั้น[แก้]
ใน พ.ศ. 2414 เมนเดเลเยฟตีพิมพ์ตารางธาตุในรูปแบบใหม่ซึ่งประกอบไปด้วยหมู่ที่มีธาตุที่คล้ายกันซึ่งจะถูกจัดในคอลัมน์มากกว่าที่จะถูกจัดในแถว และคอลัมน์เหล่านี้ก็เรียงลำดับไว้ว่า I ถึง VIII ซึ่งตรงกันกับสถานะออกซิเดชันของธาตุ เขายังลงรายละเอียดเกี่ยวกับการทำนายสมบัติของธาตุที่ยังไม่ค้นพบด้วย และเขายังระบุไว้ว่าพวกมันไม่มีในตารางธาตุ แต่ควรจะมีอยู่จริง[57] ช่องว่างเหล่านี้ส่วนใหญ่แล้วจะเติมเต็มโดยนักเคมีที่ค้นพบธาตุในธรรมชาติเพิ่มเติม[58] บ่อยครั้งที่มีการยืนยันว่าธาตุสุดท้ายที่จะถูกค้นพบในธรรมชาติคือ แฟรนเซียม (เอคา-ซีเซียมที่เมนเดเลเยฟทำนายไว้) ที่ถูกค้นพบใน พ.ศ. 2482[59] ถึงอย่างนั้น พลูโทเนียม สังเคราะห์ขึ้นใน พ.ศ. 2485 มีการยืนยันว่ามีปริมาณเพียงเล็กน้อยในธรรมชาติใน ปี พ.ศ. 2514[60] และปี พ.ศ. 2554 ก็เป็นที่รู้กันว่าทุกธาตุจนถึงแคลิฟอร์เนียมนั้นสามารถมีได้ในธรรมชาติโดยพบในแร่ยูเรเนียมโดยการจับยึดนิวตรอนและการสลายแบบบีตา ถึงแม้ว่าจะมีปริมาณน้อยก็ตาม[1]
ตารางธาตุที่ได้รับความนิยมที่สุด[61] หรือรู้จักกันว่าเป็นตารางธาตุมาตรฐาน สร้างขึ้นโดยฮอเรซ กรอฟส์ เดมิง ใน พ.ศ. 2466 เดมิงได้ตีพิมพ์ตารางธาตุในรูปแบบสั้น (รูปแบบเมนเดเลเยฟ) และรูปแบบปานกลาง (18 คอลัมน์)[62] ในปี พ.ศ. 2467 เมิร์คและคอมปานีได้จัดเตรียมเอกสารของตารางธาตุ 18 แถวของเดมิงไว้ใช้สำหรับการเรียนการสอนในโรงเรียนของประเทศสหรัฐอเมริกา ในช่วงทศวรรษ 1930 ตารางธาตุของเดมิงได้ปรากฏบนหนังสือคู่มือและสารานุกรมเคมี และมันก็ยังถูกแจกจ่ายเป็นเวลาหลายปีโดยบริษัทวิทยาศาสตร์ซาร์เจนท์-เวลช์[63][64][65]
ด้วยการพัฒนากลศาสตร์ควอนตัม และทฤษฎีของการจัดเรียงอิเล็กตรอนภายในอะตอม พบว่าอิเล็กตรอนจะเพิ่มขึ้นตามคาบ (แถวแนวนอน) ในตารางธาตุเพื่อเติมเต็มวงอิเล็กตรอน อะตอมที่มีขนาดใหญ่ขึ้นจะมีวงย่อยมากขึ้น และทำให้ตารางธาตุจะมีคาบที่ยาวขึ้นไปด้วย
ใน พ.ศ. 2488 นักวิทยาศาสตร์ชาวอเมริกัน เกลนน์ ซีบอร์ก ได้ให้ข้อคิดเห็นไว้ว่าธาตุแอกทิไนด์จะเหมือนกับแลนทาไนด์ซึ่งอิเล็กตรอนจะเข้าไปอยู่ในวงย่อย f ก่อนหน้านั้นแอกทิไนด์เชื่อกันว่าเป็นบล็อก-d แถวที่ 4 เพื่อนร่วมงานของซีบอร์กได้แนะนำให้เขาปิดบังข้อเสนอแนะดังกล่าวนี้ซึ่งจะมีผลกระทบต่ออาชีพของเขา ซีบอร์กไม่สนใจคำแนะนำของเพื่อนร่วมงาน และตีพิมพ์ข้อเสนอแนะของเขาลงไป ในภายหลังนักวิทยาศาสตร์คนอื่นๆได้ตรวจสอบข้อเสนอแนะนี้ และพบว่ามีความถูกต้อง และทำให้เขาได้รับรางวัลโนเบลสาขาเคมีในปี พ.ศ. 2494 สำหรับการทำงานของเขาที่เกี่ยวกับการสังเคราะห์ธาตุแอกทิไนด์
ถึงแม้ว่าธาตุหลังยูเรเนียมบางตัวจะปรากฏในธรรมชาติ[1] แต่พวกมันทั้งหมดก็ถูกค้นพบในห้องปฏิบัติการทางวิทยาศาสตร์มาก่อน ซึ่งการผลิตพวกมันทำให้ตารางธาตุขยายขึ้นอย่างรวดเร็ว โดยมีการสังเคราะห์เนปทูเนียมขึ้นมาเป็นธาตุแรก ซึ่งสังเคราะห์ในปี พ.ศ. 2482[69] เนื่องด้วยธาตุส่วนใหญ่หลังยูเรเนียมไปแล้วนั้น มีความไม่เสถียรสูงมาก และสลายตัวอย่างรวดเร็ว พวกมันจึงกลายเป็นความท้าทายของนักวิทยาศาสตร์ที่จะตรวจจับและระบุลักษณะขณะที่มันถูกผลิตขึ้นแล้ว พวกมันยังมีการถกเถียงในเรื่องของความถูกต้องของการค้นพบธาตุ ซึ่งบางครั้งก็ยังขาดการตรวจสอบความสำคัญและการตั้งชื่อที่ถูกต้อง ซึ่งธาตุที่ได้รับการยืนยันและได้รับการตั้งชื่อล่าสุดคือ ฟลีโรเวียม (ธาตุที่ 114) และลิเวอร์มอเรียม (ธาตุที่ 116) ทั้งคู่ถูกตั้งชื่อในวันที่ 16 พฤษภาคม พ.ศ. 2555[70] ก่อนหน้านั้นในปี พ.ศ. 2553 ศูนย์วิจัยวิทยาศาสตร์ในดุบนา ประเทศรัสเซีย ได้สังเคราะห์อะตอมของเทนเนสซีน (ธาตุที่ 117) 6 อะตอม ซึ่งทำให้มันกลายเป็นธาตุล่าสุดที่คาดว่าจะถูกค้นพบ[71] ปัจจุบัน ธาตุที่มีเลขอะตอมเท่ากับ 118 คือ Og ออกาเนสซอนยังรู้จักกันในชื่อว่า เอคา-เรดอน หรือ ธาตุ 118 และบนตารางธาตุ มันถูกจัดให้อยู่ในบล็อก-p และเป็นธาตุตัวสุดท้ายบนคาบที่ 7 ปัจจุบัน ออกาเนสซอนเป็นธาตุสังเคราะห์เพียงตัวเดียวของธาตุหมู่ 18 มันยังเป็นธาตุที่มีเลขอะตอมและมวลอะตอมมากที่สุดเท่าที่ค้นพบในปัจจุบัน
โครงสร้างรูปแบบอื่น[แก้]
มีตารางธาตุที่มีโครงสร้างอื่นนอกจากเป็นแบบมาตรฐาน ภายในระยะเวลา 100 ปีหลังจากที่ตารางธาตุของเมนเดเลเยฟถูกตีพิมพ์ในปี พ.ศ. 2412 มีการสร้างตารางธาตุที่มีโครงสร้างแตกต่างไปจากเดิมประมาณ 700 กว่าชนิด และได้รับการตีพิมพ์แล้ว[72] เช่นเดียวกับตารางธาตุในรูปแบบช่องสี่เหลี่ยมก็มีการดัดแปลงโครงสร้างเหมือนกัน ตัวอย่างเช่น[n 4] โครงสร้างวงกลม, ลูกบาศก์ ทรงกระบอก โครงสร้างคล้ายอาคาร ทรงเกลียว เลมนีสเกต ปริซึมทรงแปดเหลี่ยม พีระมิด แบบแยกออกจากกัน ทรงกลม เกลียว และรูปสามเหลี่ยม ส่วนใหญ่แล้วตารางธาตุในโครงสร้างแบบอื่น ๆ นั้น สร้างขึ้นเพื่อเน้นหรือให้ความสำคัญกับสมบัติทางเคมีหรือกายภาพของธาตุ ซึ่งไม่มีในตารางธาตุปกติ[72]
ตารางธาตุโครงสร้างอื่นที่ได้รับความนิยม[73]คือ ตารางธาตุของทืโอดอร์ เบนฟีย์ เขาสร้างขึ้นเมื่อปี พ.ศ. 2503 ธาตุถูกจัดเรียงในเกลียวที่ต่อเนื่องกัน โดยมีไฮโดรเจนอยู่ตรงกลางและมีโลหะแทรนซิชัน แลนทาไนด์ และแอกทิไนด์ ยื่นออกมาคล้ายกับคาบสมุทร[74]
ตารางธาตุส่วนใหญ่จะมีลักษณะเป็น 2 มิติ ถึงอย่างนั้นมันก็ยังมีตารางธาตุที่เป็น 3 มิติ และเป็นที่รู้จักครั้งแรกในปี พ.ศ. 2405 (ก่อนที่เมนเดเลเยฟจะตีพิมพ์ตารางธาตุของเขาในปี พ.ศ. 2412) ตัวอย่างตารางธาตุ 3 มิติที่พบเห็นได้เป็นส่วนใหญ่ เช่น การจำแนกธาตุของคูร์ทีนส์ (พ.ศ. 2468)[75] ระบบลามีนาของวริงลีย์ (พ.ศ. 2492)[76] ตารางธาตุทรงเกลียวของกีเกอเร (พ.ศ. 2508)[77] และต้นไม้พีรีออดิกของดูโฟร์ (พ.ศ. 2539)[78] ได้รับการบรรยายว่าเป็นตารางธาตุ 4 มิติ (มิติเชิงพื้นที่ 3 มิติและมิติเชิงสีอีก 1 มิติ)[79]
ธาตุที่ไม่ทราบสมบัติทางเคมี
ถึงแม้ว่าธาตุทุกตัวจนถึงออกาเนสซอนจะถูกค้นพบแล้ว แต่ธาตุที่มีเลขอะตอมมากกว่าฮัสเซียม (ธาตุที่ 108) มีเพียงแค่โคเปอร์นิเซียม (ธาตุที่ 112) และฟลีโรเวียม (ธาตุที่ 114) เท่านั้นที่ทราบสมบัติทางเคมีแล้ว ส่วนธาตุอื่น ๆ ที่มีเลขอะตอมมากกว่าฮัสเซียมนั้น สมบัติทางเคมีของมันเป็นเพียงแค่การทำนายโดยการประมาณค่าหรือพิจารณาความสัมพันธ์ทางเคมี เช่น ทำนายว่าฟลีโรเวียมจะมีสมบัติที่คล้ายคลึงกับธาตุในหมู่แก๊สมีตระกูล แม้ว่าปัจจุบันมันจะจัดให้อยู่ในหมู่คาร์บอนก็ตาม[80] การทดลองส่วนใหญ่ได้บ่งชี้เช่นนั้น ถึงอย่างนั้น ฟลีโรเวียมแสดงความประพฤติทางเคมีเหมือนกับตะกั่วตามตำแหน่งของธาตุที่คาดไว้[81]
การขยายตารางธาตุ
ไม่มีความแน่ชัดว่าธาตุใหม่ที่จะถูกค้นพบต่อไปนี้จะต้องไปอยู่ในคาบที่ 8 หรือต้องการการปรับเปลี่ยนรูปแบบตารางธาตุ ซีบอร์กคาดว่าคาบที่ 8 นี้จะเป็นไปตามหลักการที่กำหนดไว้ มันจะประกอบไปด้วยธาตุในบล็อก-s 2 ตัว คือธาตุที่ 119 และ 120 หลังจากนั้นจะเป็นบล็อก-g สำหรับธาตุตัวถัดไปอีก 18 ตัว และที่เหลืออีก 30 ตัวจะถูกจัดให้อยู่ในบล็อก-f -d และ -p ตามลำดับ[82] ล่าสุด นักฟิสิกส์หลายคนเช่น เปกกา ปียักโก เชื่อว่าธาตุใหม่ที่จะถูกค้นพบนั้นจะไม่เป็นไปตามกฎของแมนเดลัง ซึ่งเป็นการทำนายว่าจะมีวงอิเล็กตรอนเท่าใด และจะทำให้ตารางธาตุปัจจุบันมีหน้าตาเปลี่ยนไปด้วย[83]
ธาตุที่มีเลขอะตอมมากที่สุด
ตัวเลขของจำนวนธาตุที่เป็นไปได้ยังไม่มีใครทราบ มีข้อคิดเห็นที่เก่าที่สุดสำหรับเรื่องนี้ ซึ่งเสนอโดย เอเลียต อดัมส์ ในปี พ.ศ. 2454 และอยู่บนพื้นฐานของการจัดเรียงธาตุในแถวแนวนอนของตารางธาตุ เขาเชื่อว่าธาตุที่มีมวลอะตอมมากกว่า 256± (ซึ่งเทียบเท่ากับมวลอะตอมระหว่างธาตุที่ 99 และ 100 ในปัจจุบัน) จะไม่ปรากฏขึ้น[84] ธาตุที่มีมวลอะตอมสูงกว่านี้ คาดว่าจะไปสิ้นสุดไม่ไกลหลังจากหมู่เกาะแห่งความเสถียรภาพ[85] ซึ่งทำนายกันว่าจะมีศูนย์กลางประมาณธาตุที่ 126 และเป็นส่วนขยายของตารางธาตุและตารางนิวไคลด์จะถูกจำกัดโดยดริปไลน์ (Drip line) ของโปรตอนและนิวตรอน[86] มีการทำนายอื่น ๆ อีกมากมายที่นำเสนอเกี่ยวกับจุดสิ้นสุดของตารางธาตุ รวมทั้งตารางธาตุจะสิ้นสุดที่ธาตุ 128 ซึ่งเสนอโดยจอห์น เอมสลีย์[1] สิ้นสุดที่ธาตุ 137 โดยริชาร์ด ไฟน์แมน[87] และสิ้นสุดที่ธาตุ 155 โดยอัลเบิร์ต คาซาน[1][n 5]
- แบบจำลองของบอร์
แบบจำลองของบอร์จะมีความยากลำบากในการอธิบายถึงอะตอมของธาตุที่มีเลขอะตอมเท่ากับ 137 ขึ้นไป ธาตุใด ๆ ก็ตามที่มีเลขอะตอมมากกว่า 137 มันจะต้องการอิเล็กตรอนในวงย่อย 1s เพื่อที่จะให้เดินทางได้เร็วกว่าแสง[88] ดังนั้นแบบจำลองของบอร์จึงไม่ได้ถูกใช้เพื่ออธิบายความสัมพันธ์ที่ถูกต้องของธาตุเหล่านั้น
- สมการแสดงความสัมพันธ์ของดิแรก
สมการแสดงความสัมพันธ์ของดิแรกจะมีปัญหาเมื่อธาตุนั้นมีโปรตอนมากกว่า 137 ตัว สำหรับธาตุเหล่านั้น ฟังก์ชันคลื่นของสถานะพื้นของดิแรกจะเกิดการแกว่งมากกว่าที่จะยึดกันไว้ และจะไม่มีช่องว่างระหว่างพลังงานบวกและลบของสเปกตรัม ซึ่งมีในปฏิทรรศน์ของไคลน์[89] การคำนวณที่แม่นยำขึ้นโดยคำนึงถึงผลกระทบของการจำกัดขนาดของนิวเคลียส แสดงให้เห็นว่าพลังงานที่ทำให้นิวเคลียสอยู่รวมกัน จะมีค่าเกินขีดจำกัดสำหรับธาตุที่มีโปรตอนมากกว่า 137 ตัว สำหรับธาตุที่หนักกว่านั้น ถ้าวงอิเล็กตรอนชั้นในสุด (1s) ไม่ถูกเติมเต็ม จะทำให้สนามไฟฟ้าของนิวเคลียสจะดึงอิเล็กตรอนออกจากสุญญากาศ ส่งผลให้อะตอมนั้นเกิดการปล่อยโพซิตรอนออกมาโดยธรรมชาติ[90] ถึงอย่างนั้น ผลกระทบนี้จะไม่เกิดขึ้นถ้าวงอิเล็กตรอนชั้นในสุดได้รับการเติมเต็มแล้ว ดังนั้นธาตุที่ 137 จึงไม่จำเป็นว่าจะเป็นที่สิ้นสุดของตารางธาตุ[91]
ตำแหน่งของไฮโดรเจนและฮีเลียม
บ่อยครั้งที่ไฮโดรเจนและฮีเลียมถูกวางในตำแหน่งที่แตกต่างกัน แทนที่จะวางใกล้กัน เนื่องด้วยการจัดเรียงอิเล็กตรอน ไฮโดรเจนส่วนใหญ่จะถูกจัดให้อยู่บนลิเทียม โดยพิจารณาจากการจัดเรียงอิเล็กตรอน แต่บางครั้งมันก็จะถูกจัดให้อยู่เหนือฟลูออรีน[92]หรือคาร์บอน[92] เนื่องจากไฮโดรเจนแสดงพฤติกรรมที่มีความคล้ายคลึงกับธาตุเหล่านั้น บางครั้งไฮโดรเจนอาจจะถูกจัดให้อยู่เดี่ยว ๆ ซึ่งหมายความว่าไฮโดรเจนไม่มีสมบัติเหมือนกับธาตุในหมู่ใด ๆ เลย[93] ฮีเลียม ส่วนใหญ่แล้วจะถูกจัดให้อยู่เหนือนีออน เพราะมีสมบัติทางเคมีคล้ายคลึงกันมาก ถึงแม้ว่าบางครั้งมันจะถูกจัดให้อยู่เหนือเบริลเลียมเนื่องด้วยการจัดเรียงอิเล็กตรอน (ฮีเลียม: 1s2 เบริลเลียม: [He] 2s2)[19]
หมู่ของโลหะแทรนซิชัน
นิยามของโลหะแทรนซิชันโดยไอยูแพกนั้น คือธาตุที่อิเล็กตรอนนั้นจะเข้าไปอยู่ในวงย่อย d หรือจะเป็นประจุบวกเพื่อเติมเต็มวงย่อย d[94] จากคำนิยามนี้ ทำให้ธาตุในหมู่ 3–11 เป็นโลหะแทรนซิชัน คำนิยามของไอยูแพกทำให้ธาตุในหมู่ 12 ซึ่งประกอบด้วยสังกะสี แคดเมียม และปรอท ออกจากการเป็นโลหะแทรนซิชันไป
นักเคมีบางคนอธิบายว่า "ธาตุบล็อก-d" และ "โลหะแทรนซิชัน" สามารถสลับกันได้ ซึ่งทำให้หมู่ที่ 3–12 กลายเป็นโลหะแทรนซิชัน ในกรณีนี้ธาตุหมู่ 12 จะถือว่าเป็นกรณีพิเศษของโลหะแทรนซิชัน เพราะธาตุหมู่ 12 ไม่ได้ใช้อิเล็กตรอนในวงย่อย d ในการทำพันธะกับธาตุอื่น แต่การค้นพบล่าสุด พบว่าปรอทสามารถใช้อิเล็กรอนในวงย่อย d ในการสร้างพันธะกับฟลูออรีน เป็นเมอร์คิวรี(IV) ฟลูออไรด์ (HgF4) ทำให้มีนักเคมีบางคนเสนอว่าปรอทควรจะถูกจัดให้เป็นโลหะแทรนซิชัน[95] ส่วนนักเคมีคนอื่น ๆ เช่น เจนเซน[96] แย้งว่าการเกิดของ HgF4 สามารถเกิดได้ในภาวะที่ผิดปกติอย่างมากเท่านั้น ดังนั้นปรอทจึงไม่ถูกจัดให้เป็นโลหะแทรนซิชัน โดยการพิจารณาความหมายโดยสามัญ[96]
แต่ก็ยังมีนักเคมีบางคนที่ไม่รวมธาตุหมู่ 3 ในกลุ่มโลหะแทรนซิชัน โดยคำนิยามของโลหะแทรนซิชัน พวกเขาทำบนพื้นฐานที่ว่าธาตุในหมู่ 3 ไม่มีไอออนใด ๆ ที่สามารถไปเติมเต็มวงย่อย d ได้ และไม่แสดงสมบัติทางเคมีที่คล้ายคลึงกับโลหะแทรนซิชันเลย[97] ในกรณีนี้ธาตุหมู่ 4–11 จะถูกจัดให้เป็นโลหะแทรนซิชัน[98]
ธาตุคาบ 6 และ 7 ในหมู่ที่ 3
ถึงแม้ว่าสแกนเดียมและอิตเทรียมจะเป็นธาตุหมู่ 3 สองตัวแรกตลอด ตัวตนของธาตุอีกสองตัวยังไม่ได้ถูกยืนยัน พวกมันอาจจะเป็นแลนทานัมกับแอกทิเนียมหรือลูทีเชียมกับลอว์เรนเชียม ถึงแม้มันยังมีข้อโต้แย้งทางเคมีและกายภาพที่สนับสนุนการจัดโดยนำลูทีเชียมและลอว์เรนเชียมเป็นธาตุหมู่ 3 แต่ก็ไม่ควรที่จะเชื่อถือนัก[99] คำนิยามปัจจุบันของคำว่า "แลนทาไนด์" ของไอยูแพก รวมธาตุ 15 ตัว ซึ่งมีทั้งแลนทานัมและลูทีเชียม และ "โลหะแทรนซิชัน"[94] อาจจะเป็นแลนทานัมหรือแอกทิเนียมก็ได้ หรือแม้กระทั่งลูทีเชียม แต่ไม่ใช่ลอว์เรนเชียม เนื่องจากหลักการออฟบาวไม่มีความถูกต้องแล้ว โดยทั่วไป อิเล็กตรอนของลอว์เรนเชียมตัวที่ 103 จะต้องเข้าไปอยู่ในวงย่อย d แต่การวิจัยทางกลศาสตร์ควอนตัมชี้ให้เห็นว่าลอว์เรนเชียมมีการจัดเรียงอิเล็กตรอนเป็น [Rn] 5f14 7s2 7p1[n 6] เนื่องด้วยผลกระทบจากความสัมพันธ์ระหว่างธาตุเคมี[100][101] ไอยูแพกจึงยังไม่ได้แนะนำรูปแบบที่เจาะจง สำหรับธาตุในบล็อก-f และยังคงเป็นข้อโต้แย้งต่อไป
ตารางธาตุในรูปแบบที่เหมาะสม
มีตารางธาตุหลายรูปแบบที่ถูกเสนอว่าควรจะเป็นตารางธาตุที่มีรูปแบบเหมาะสม คำตอบของคำถามนี้ขึ้นอยู่กับว่าตารางธาตุนั้นบอกรายละเอียดเกี่ยวกับธาตุได้พอดีและอยู่บนพื้นฐานของความจริงหรือไม่ แต่ทั้งหมดก็ขึ้นอยู่กับการสังเกตการณ์ของมนุษย์ ตารางธาตุที่เหมาะสมนั้นจะต้องอธิบายได้ว่าไฮโดรเจนและฮีเลียมควรจะอยู่ที่ไหน และธาตุหมู่ 3 จะมีอะไรบ้าง คำตอบดังกล่าวจะต้องอยู่บนพื้นฐานของความจริงด้วยเช่นกัน ถ้ามีความจริงนั้นอยู่แล้ว มันอาจจะยังไม่ถูกค้นพบ ในกรณีที่ไม่มีคำตอบ การนำตารางธาตุหลายรูปแบบมารวมกัน ก็สามารถทำให้ตารางธาตุสมบูรณ์แบบขึ้นได้ และมีการเน้นแง่มุมที่แตกต่างกันของสมบัติทางเคมีและความสัมพันธ์ระหว่างธาตุ ความแพร่หลายของตารางธาตุในรูปแบบมาตรฐาน หรือรูปแบบยาว อาจจะเป็นตารางธาตุที่ดีแล้ว มีความสมดุลของเอกลักษณ์ในแง่ของโครงสร้างและขนาด การเรียงธาตุตามสมบัติของอะตอมและแนวโน้มพีรีออดิก
สมบัติอะตอมตามตารางธาตุ
ตารางธาตุ เป็นอีกหนึ่งเครื่องมือของนักเคมีที่ช่วยจัดระเบียบของธาตุต่าง ๆ ที่ค้นพบ ทำให้เราจำสมบัติของธาตุได้ง่ายเนื่องจากสมบัติเหล่านั้นของธาตุในตารางธาตุมีแนวโน้มอย่างชัดเจน ดังนั้นถ้าเราทราบสมบัติของธาตุหนึ่ง เราก็สามารถทำนายสมบัติของธาตุอื่นได้ด้วย เช่น เราทราบว่าขนาดอะตอมของ Li เท่ากับ 152 พิโคเมตร แล้วขนาดอะตอมของ Be เป็นเท่าใด เราสามารถตอบอย่างคร่าว ๆ ว่า "ควรจะมีขนาดอะตอมน้อยกว่า 152 พิโคเมตร" เป็นต้น
สมบัติของอะตอมตามตารางธาตุ ได้แก่
1.ขนาดอะตอม (atomic size)
2.พลังงานไอออไนเซชัน (ionization energy; IE)
3.สัมพรรคภาพอิเล็กตรอน (electron affinity; EA)
4.อิเล็กโทรเนกาติวิตี (electronegativity; EN)
2.พลังงานไอออไนเซชัน (ionization energy; IE)
3.สัมพรรคภาพอิเล็กตรอน (electron affinity; EA)
4.อิเล็กโทรเนกาติวิตี (electronegativity; EN)
ขนาดอะตอม (atomic size)
|
ความหมาย
ขนาดของอะตอม วัดจากระยะห่างระหว่างนิวเคลียสของอะตอมที่อยู่ติดกัน สำหรับธาตุที่อยู่ในลักษณะโมเลกุลอะตอมคู่ รัศมีอะตอมจะถือว่าเป็นครึ่งหนึ่งของระยะระหว่างนิวเคลียสของ 2 อะตอมในโมเลกุล

จากรูป ระยะห่างระหว่างอะตอมของคลอรีนเท่ากับ 99 พิโคเมตร ส่วนคาร์บอนเท่ากับ 77 พิโคเมตร
แนวโน้มขนาดอะตอมของธาตุต่าง ๆ ในตารางธาตุ
ปัจจัยที่มีผลต่อขนาดอะตอม
1. เลขควอนตัมหลัก(n)ของเวเลนซ์อิเล็กตรอน
2. ประจุนิวเคลียสสุทธิ(effective nuclear charge;Zeff)
- ธาตุในหมู่เดียวกัน ขนาดของอะตอมใหญ่ขึ้นจากบนลงล่าง เพราะธาตุที่อยู่ด้านล่างมีเลขควอนตัมหลักของเวเลนซ์อิเล็กตรอนมาก หรืออาจกล่าวว่า ขนาดของอะตอมมีขนาดใหญ่ขึ้นตามเลขควอนตัมหลักที่เพิ่มขึ้น ยกตัวอย่างเช่น ธาตุในหมู่ IA ขนาดอะตอม Li < Na < K < Rb < Cs
- ธาตุในคาบเดียวกัน ขนาดของอะตอมเล็กลงจากซ้ายไปขวา เพราะประจุนิวเคลียสสุทธิเพิ่มขึ้น จึงดึงดูดเวเลนซ์อิเล็กตรอนมากขึ้น ขนาดอะตอมจึงเล็กลง ในขณะที่เลขควอนตัมหลักของเวเลนซ์อิเล็กตรอนคงที่ ยกตัวอย่างเช่น ธาตุในคาบที่ 2 ขนาดอะตอม Li > Be > B > C > N > O > F
พลังงานไอออไนเซชัน(ionization energy)
ความหมายพลังงานไอออไนเซชันคือ พลังงานที่ใช้ในการดึงอิเล็กตรอน 1 อนุภาค ออกจากอะตอมในสถานะแก๊ส กลายเป็นไอออนบวก
Li(g)
- ธาตุที่มีอิเล็กตรอน 1 ตัว คือ ธาตุไฮโดรเจน(H)
H(g)
ธาตุไฮโดรเจนมีพลังงานไอออไนเซชันเท่ากับ 1,318 กิโลจูลต่อโมล แสดงว่าเราต้องให้พลังงานแก่ธาตุไฮโดรเจน 1,318กิโลจูลต่อโมล จึงจะทำให้อิเล็กตรอนหลุดออกมา
- ธาตุที่มีอิเล็กตรอนมากกว่า 1 ตัว เช่น ธาตุลิเทียม(Li)
Li(g) Li+(g) Li2+(g)
จากการสังเกตจากค่าพลังงานไอออไนเซชันจะพบว่า IE1คือพลังงานที่ให้แก่อะตอมเพื่อดึงอิเล็กตรอนที่อยู่วงนอกสุด(เวเลนซ์อิเล็กตรอน) มีค่าน้อยที่สุด เพราะอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสหลุดออกได้ง่าย ไม่ต้องใช้พลังงานมากเพราะได้รับแรงดึงดูดจากนิวเคลียสน้อย แต่อิเล็กตรอนที่อยู่ใกล้นิวเคลียสจะถูกดึงดูดไว้เราต้องใช้พลังงานมาก เพื่อที่จะทำให้อิเล็กตรอนนั้นหลุดออกมา ดังนั้นค่า IE3จึงมีค่ามากที่สุด
|
แนวโน้มพลังงานไอออไนเซชันของธาตุต่าง ๆ ในตารางธาตุ
- ธาตุในหมู่เดียวกัน พลังงานไอออไนเซชันลดลงจากบนลงล่าง เพราะระยะห่างระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนลดลง อิเล็กตรอนจึงหลุดจากอะตอมได้ง่าย เช่น ธาตุในหมู่ IA
พลังงานไอออไนเซชัน Li > Na > K > Rb > Cs > Fr
- ธาตุในคาบเดียวกัน พลังงานไอออไนเซชันเพิ่มขึ้นจากซ้ายไปขวา เพราะค่าประจุนิวเคลียสสุทธิมากขึ้น อะตอมขนาดเล็ก จึงมีแรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนมากขึ้น ทำให้อิเล็กตรอนหลุดยาก จึงต้องใช้พลังงานสูงในการดึงอิเล็กตรอนออกจากอะตอม เช่น ธาตุในคาบที่ 2 พลังงานไอออไนเซชัน Li < Be < B < C < N < O < F
พลังงานไอออไนเซชัน Li > Na > K > Rb > Cs > Fr
- ธาตุในคาบเดียวกัน พลังงานไอออไนเซชันเพิ่มขึ้นจากซ้ายไปขวา เพราะค่าประจุนิวเคลียสสุทธิมากขึ้น อะตอมขนาดเล็ก จึงมีแรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนมากขึ้น ทำให้อิเล็กตรอนหลุดยาก จึงต้องใช้พลังงานสูงในการดึงอิเล็กตรอนออกจากอะตอม เช่น ธาตุในคาบที่ 2 พลังงานไอออไนเซชัน Li < Be < B < C < N < O < F
สัมพรรคภาพอิเล็กตรอน (electron affinity)
ความหมายสัมพรรคภาพอิเล็กตรอนคือ พลังงานที่อะตอมในสถานะแก๊สคายออกมาเมื่อได้รับอิเล็กตรอน
สมบัติของอะตอมตามตารางธาตุ 2
สัมพรรคภาพอิเล็กตรอน (electron affinity) ความหมาย
สัมพรรคภาพอิเล็กตรอนคือ พลังงานที่อะตอมในสถานะแก๊สคายออกมาเมื่อได้รับอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอนคือ พลังงานที่อะตอมในสถานะแก๊สคายออกมาเมื่อได้รับอิเล็กตรอน
แนวโน้มสัมพรรคภาพอิเล็กตรอนของธาตุต่าง ๆ ในตารางธาตุ
- ค่าสัมพรรคภาพอิเล็กตรอนเป็นลบเพราะระบบ(อะตอม)คายพลังงานออกมาเมื่อรับอิเล็กตรอนเข้าไป ตามหลักเทอร์โมไดนามิกส์(thermodynamics)
- ถ้าเราพิจารณาค่าสัมพรรคภาพอิเล็กตรอนโดยไม่คำนึงถึงค่าที่เป็นลบ จะเห็นว่า
- ธาตุในหมู่เดียวกัน สัมพรรคภาพอิเล็กตรอนลดลงจากบนลงล่าง เช่น ธาตุในหมู่ IA
สัมพรรคภาพอิเล็กตรอน Li > Na > K > Rb > Cs แสดงว่า Li รับอิเล็กตรอนเข้ามาในอะตอมได้ดีกว่า Cs
- ธาตุในคาบเดียวกัน สัมพรรคภาพอิเล็กตรอนเพิ่มขึ้นจากซ้ายไปขวา เช่น ธาตุในคาบที่ 2
สัมพรรคภาพอิเล็กตรอน Li < Be < B < C < N < O < F แสดงว่า F รับอิเล็กตรอนเข้ามาในอะตอมได้ดีกว่า Li
- ถ้าเราพิจารณาค่าสัมพรรคภาพอิเล็กตรอนโดยไม่คำนึงถึงค่าที่เป็นลบ จะเห็นว่า
- ธาตุในหมู่เดียวกัน สัมพรรคภาพอิเล็กตรอนลดลงจากบนลงล่าง เช่น ธาตุในหมู่ IA
สัมพรรคภาพอิเล็กตรอน Li > Na > K > Rb > Cs แสดงว่า Li รับอิเล็กตรอนเข้ามาในอะตอมได้ดีกว่า Cs
- ธาตุในคาบเดียวกัน สัมพรรคภาพอิเล็กตรอนเพิ่มขึ้นจากซ้ายไปขวา เช่น ธาตุในคาบที่ 2
สัมพรรคภาพอิเล็กตรอน Li < Be < B < C < N < O < F แสดงว่า F รับอิเล็กตรอนเข้ามาในอะตอมได้ดีกว่า Li
อิเล็กโทรเนกาติวิตี (electronegativity)
| |
ความหมาย
อิเล็กโทรเนกาติวิตี หมายถึงความสามารถในการดึงดูดอิเล็กตรอนในพันธะเข้ามาหาตัวเอง
แนวโน้มอิเล็กโทรเนกาติวิตีของธาตุต่าง ๆ ในตารางธาตุ
ตารางธาตุประกอบด้วยธาตุ 8 หมู่
1.ธาตุหมู่ Iมีสมบัติเป็นโลหะซึ่งมีคุณสมบัติว่องไวในการผสมธาตุมาก ธาตุหมู่ I เรียกว่า alkalai metalและมีอิเล็กตรอนวงนอกสุดอยู่ 1 ตัว
2.ธาตุหมู่ IIเป็นธาตุโลหะ มีอิเล็กตรอนวงนอกสุด 2 ตัว ธาตุที่ว่องไวที่สุดในหมู่นี้ คือเรเดียม (Ra)
3.ธาตุหมู่ IIIจะเริ่มประกอบด้วยโลหะและอโลหะ มีอิเล็กตรอนวงนอกสุด 3 ตัว
4.ธาตุหมู่ IVมีอิเล็กตรอนวงนอกสุด 4 ตัว
5.ธาตุหมู่ Vในตอนต้น ๆ จะเป็นอโลหะ ธาตุถัดมา เช่น สารหนู (As) และอันติโนมี (Sb)
จะแสดงคุณสมบัติระหว่างโลหะและอโหดก้ำกึ่งกัน ลักษณะเช่นนี้เรียกว่ามีสมบัติเป็น metalloid
6.ธาตุหมู่ VIตอนต้นหมู่จะมีธาตุที่มีสมบัติเป็นอโลหะ แล้วค่อย ๆ เป็นโลหะ
7.ธาตุหมู่ VIIมีชื่อเรียกว่า Halogen group ธาตุหมู่นี้เป็นอโลหะ ที่ว่องไวในการผสมธาตุมาก
8.ธาตุหมู่ VIIIจัดเป็นธาตุ Inert gas จึงไม่ค่อยทำปฏิกิริยากับธาตุอื่น เพราะมีอิเล็กตรอนวงนอกสุดเท่ากับ8
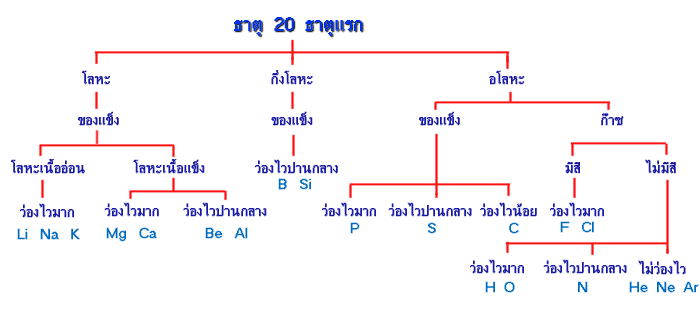
การจัดกลุ่มธาตุ 20 ธาตุแรกโดยใช้เกณฑ์ย่อย
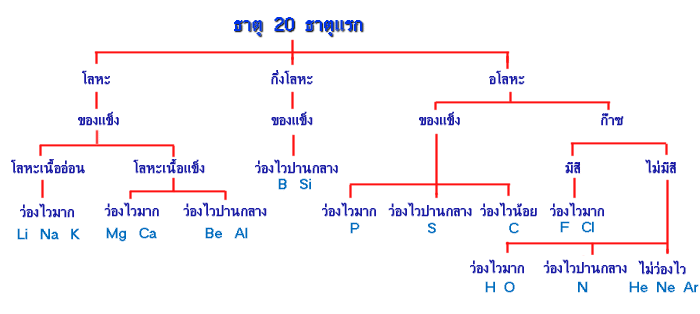
หมู่ธาตุทรานซิชั่น (Transition elements )ได้แก่
Lanthanide seriesประกอบด้วยธาตุที่มี Atomic number 57 - 70 เป็นธาตุที่หายากมาก
Actinide seriesประกอบด้วยธาตุที่มี Atomic number 89 - 102
ธาตุในหมู่นี้มีคุณสมบัติเป็นสารกัมมันตรังสี
ธาตุในแนวตั้งเรียกว่าหมู่(group)แบ่งออกเป็น18แถวและแบ่งเป็นกลุ่มย่อยๆ
2กลุ่มคือ กลุ่มย่อยAเรียกว่าธาตุเรพรีเซนเตติฟ(Representativeelements)มี8แถวคือหมู่I AถึงVIIIAมีชื่อของกลุ่มธาตุดังนี้
หมู่I Aเรียกว่าโลหะอัลคาไลน์(Alkalimetals)คือLiNaKRbCsFe
หมู่II Aเรียกว่าโลหะอัลคาไลน์เอิร์ท(Alkalineearthmetals)คือBeMgCaSrBaRa หมู่VII Aเรียกว่าหมู่ธาตุแฮโลเจน(Halogens)คือFClBrIAt หมู่VIII Aเรียกว่าก๊าซเฉื่อยหรือก๊าซมีตระกูล(InertgasesหรือNoblegases)คือHeNeArKrXeRn กลุ่มย่อยBเรียกว่าธาตุทรานซิชัน(Transitionelements)แบ่งออกเป็น8หมู่แต่มี 10แถว โดยธาตุหมู่VIII Bมี3แถวและมีชื่อของกลุ่มธาตุดังนี หมู่III Bเรียกว่าแรร์เออร์ท(Rareearth)คือScYLaAc กลุ่มธาตุแลนทาไนด์เป็นธาตุกลุ่มย่อยที่แยกออกมาจากหมู่III Bในคาบที่6คือCeLu กลุ่มธาตุแอกติไนด์เป็นธาตุกลุ่มย่อยที่แยกออกมาจากหมู่III Bในคาบที่7คือThLr กลุ่มธาตุแลนทาไนด์ และกลุ่มธาตุแอกติไนด์เรียกว่าอินเนอร์ทรานซิชัน(Innertransitionelements) ธาตุที่อยู่ในหมู่เดียวกันจะมีวาเลนต์อิเลคตรอนเท่ากันและจำนวนวาเลนต์อิเลคตรอนจะตรงกับเลขหมู่ของธาตุในกลุ่มย่อย Aเช่น ธาตุหมู่I Aมีวาเลนต์อิเลคตรอนเท่ากับ1 ธาตุหมู่II Aมีวาเลนต์อิเลคตรอนเท่ากับ2 ธาตุหมู่III Aมีวาเลนต์อิเลคตรอนเท่ากับ3 ธาตุหมู่V Aมีวาเลนต์อิเลคตรอนเท่ากับ5 ธาตุหมู่VII Aมีวาเลนต์อิเลคตรอนเท่ากับ7 ธาตุหมู่VIII Aมีวาเลนต์อิเลคตรอนเท่ากับ 8
แบ่งออกเป็น7คาบคือ คาบที่ 1 มี >2ธาตุคือHHe
คาบที่2มี8ธาตุคือLiBeBCNOFNe คาบที่3มี8ธาตุคือNaMgAlSiPSClAr คาบที่4มี18ธาตุคือK  Kr Krคาบที่5มี18ธาตุคือRb  X Xคาบที่6มี32ธาตุคือCs  Rnและธาตุแลนทาไนด์Cr Rnและธาตุแลนทาไนด์Cr Lu Luคาบที่7มี20ธาตุคือFr  Unhและธาตุแอกติไนด์Th Unhและธาตุแอกติไนด์Th Lr Lrธาตุที่อยู่ในคาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากันและจำนวนระดับพลังงานจะตรงกับเลขประจำคาบทั้งธาตุในกลุ่มย่อยAและBเช่น ธาตุคาบที่1มีจำนวนระดับพลังงานเท่ากับ1 ธาตุคาบที่2มีจำนวนระดับพลังงานเท่ากับ2 ธาตุคาบที่3มีจำนวนระดับพลังงานเท่ากับ3ธาตุคาบที่4มีจำนวนระดับพลังงานเท่ากับ4ธาตุคาบที่5มีจำนวนระดับพลังงานเท่ากับ5 ธาตุคาบที่6มีจำนวนระดับพลังงานเท่ากับ6ธาตุคาบที่7มีจำนวนระดับพลังงานเท่ากับ7
การตั้งชื่อธาตุที่ค้นพบใหม่
จากตารางธาตุในรูปที่ 5.13 จะพบว่ามีธาตุอยู่ 106 ธาตุ ซึ่งยังมีการค้นพบธาตุใหม่ ๆ เพิ่มขึ้นอีกหลายธาตุ แต่ยังไม่ได้กำหนดสัญลักษณ์ที่แน่นอนไว้ในตารางธาตุ ธาตุบางธาตุถูกค้นพบโดยนักวิทยาศาสตร์หลายคณะ ทำให้มีชื่อเรียกและสัญลักษณ์ต่างกัน
เช่น ธาตุที่ 104 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะ คือ คณะของนักวิทยาศาสตร์สหรัฐอเมริกา ซึ่งเรียกชื่อว่า รัทเทอร์ฟอร์เดียม (Ratherfordium) และใช้สัญลักษณ์ Rf ในขณะที่คณะนักวิทยาศาสตร์สหภาพโซเวียตเรียกชื่อว่าเคอร์ซาโตเวียม (Kurchatovium) และใช้สัญลักษณ์ Ku
ธาตุที่ 105 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะเช่นเดียวกัน คือคณะนักวิทยาศาสตร์สหรัฐอเมริกาเรียกชื่อว่า ฮาห์เนียม (Hahnium) และใช้สัญลักษณ์ Ha ในขณะที่นักวิทยาศาสตร์สหภาพโซเวียตใช้ชื่อว่า นิลส์บอห์เรียม (Neilbohrium) และใช้สัญลักษณ์เป็น Ns
การที่คณะนักวิทยาศาสตร์ต่างคณะตั้งชื่อแตกต่างกัน ทำให้เกิดความสับสน International Union of Pure and Applied Chemistry (IUPAC) จึงได้กำหนดระบบการตั้งชื่อขึ้นใหม่ โดยใช้กับชื่อธาตุที่มีเลขอะตอมเกิน 100 ขึ้นไป ทั้งนี้ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย ium
ระบบการนับเลขในภาษาละตินเป็นดังนี้
0 = nil (นิล) 1 = un (อุน)
2 = bi (ไบ) 3 = tri (ไตร)
4 = quad (ควอด) 5 = pent (เพนท์)
6 = hex (เฮกซ์) 7 = sept (เซปท์)
8 = oct (ออกตฺ) 9 = enn (เอนน์)
เช่น
ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า อุนนิลควอเดียม (Unnilquadium) สัญลักษณ์ Unq
ธาตุที่ 105 ตามระบบ IUPAC อ่านว่า อุนนิลเพนเทียม (Unnilpentium) สัญลักษณ์ Unp
การจัดตารางธาตุเป็นหมู่เป็นคาบ ทำให้ศึกษาสมบัติต่าง ๆ ของธาตุได้ง่ายขึ้น สามารถทำนายสมบัติบางประการของธาตุบางธาตุได้ กล่าวคือธาตุที่อยู่ในหมู่เดียวกันจะมีสมบัติต่าง ๆ คล้าย ๆ กัน และธาตุที่อยู่ในคาบเดียวกัน จะมีแนวโน้มของการเปลี่ยนแปลงสมบัติต่าง ๆ ต่อเนื่องกันไป ซึ่งจะกล่าวถึงรายละเอียดต่อไป
(4).jpg) 
ประโยชน์ของตารางธาตุ

นอกจากนั้นตารางธาตุยังสามารถทำนายสมบัติทางเคมีของธาตุได้ว่า ธาตุใดควรจะมีสมบัติคล้ายกับธาตุใด และถ้าธาตุมีสมบัติคล้ายกัน สารประกอบประเภทเดียวกันของธาตุเหล่านั้นก็น่าจะมีสมบัติในทำนองเดียวกันเช่นNaClมีสมบัติส่วนใหญ่คล้าย KCl, RbCl, เพราะ Na, K และ Rb ต่างก็อยู่ในหมู่ IA หรือ ธาตุที่ 104 ( Rf ) และ 105 (Ha) ซึ่งเป็นธาตุที่สร้างขึ้นมีสมบัติคล้ายกับ(Hf)และ(Ta)ตามลำดับ
นอกจากนี้ยังสามารถระบุได้อีกว่าธาตุต่างๆ จะมีสมบัติใดที่แตกต่างกัน เช่น ( H2 SO 4 ) และ ( H 2 TeO 4 ) แม้ว่า S และ Te จะอยู่ในหมู่ VIA ด้วยกัน แต่สมบัติของสารประกอบทั้งสองมีความแตกต่างกันอยู่
สรุปได้ว่า ตารางธาตุมีประโยชน์ ดังนี้
1. การจัดธาตุเป็นหมู่และคาบ ทำให้ทราบสมบัติของธาตุในหมู่เดียวกันได้
2. สามารถที่จะทราบสมบัติต่าง ๆ จากธาตุในหมู่เดียวกัน
3. นำไปทำนายสมบัติของธาตุต่าง ๆ ที่ยังไม่ทราบในปัจจุบันไว้ล่วงหน้าได้
4. ทำให้การศึกษาเรื่องสมบัติของธาตุ เป็นไปอย่างรวดเร็ว
ฉะนั้น ตารางธาตุจึงมีความสำคัญในการศึกษาธาตุต่างๆเป็นอย่างมาก เป็นการเรียบเรียงธาตุอย่างเป็นระบบ เพื่อให้ผู้ศึกษาสามารถเข้าใจได้ง่าย และมีระบบการคิดและจดจำธาตุต่างๆ
|




















ไม่มีความคิดเห็น:
แสดงความคิดเห็น